Dolore è una funzione molto importante del corpo umano, incluso il coinvolgimento dei nocicettori e del sistema nervoso centrale, o SNC, per trasmettere messaggi dalla stimolazione nociva al cervello. I nocicettori sono ghiandole surrenali responsabili della rilevazione di stimoli pericolosi o dannosi e della trasmissione di segnali elettrici nel sistema nervoso. I recettori sono presenti nella pelle, nei visceri, nei muscoli, nelle articolazioni e nelle meningi per scoprire una gamma di stimolazione che potrebbe essere meccanica, termica o chimica.
Esistono due tipi di nocicettori:
- Le fibre C sarebbero il tipo più comune e sono lente nel condurre e rispondere agli stimoli. Come le proteine nella membrana del recettore convertono la stimolazione in impulsi elettrici che possono essere presi attraverso il sistema nervoso.
- È noto che le fibre A-delta conducono più rapidamente e trasmettono messaggi di dolore acuto e momentaneo.
Inoltre, ci sono nocicettori silenti che di solito sono limitati agli stimoli ma possono essere "risvegliati" con una stimolazione meccanica ad alta intensità in risposta ai mediatori chimici del corpo. I nocicettori possono avere diverse stazioni voltmetriche per la trasduzione che causano un insieme di potenziali d'azione per iniziare la segnalazione elettrica al sistema nervoso. L'eccitabilità e il comportamento della cellula sono basati sui tipi di canali all'interno del nocicettore.
È importante distinguere tra nocicezione e dolore considerando il meccanismo del dolore. La nocicezione è la normale risposta del corpo agli stimoli nocivi, inclusi i riflessi al di sotto della sovrasostasi che proteggono il corpo umano dalle lesioni. Il dolore viene appena percepito quando la soglia per cui i nocicettori riescono a raggiungere un'azione e inizia il percorso del dolore, che è relativamente alto. Lo scopo di questo articolo è di dimostrare i meccanismi cellulari e molecolari del dolore, compreso il dolore acuto e il dolore cronico, o il dolore persistente, come indicato di seguito.
Sommario
Meccanismi cellulari e molecolari del dolore
Astratto
Il sistema nervoso rileva e interpreta una vasta gamma di stimoli termici e meccanici nonché sostanze irritanti chimiche ambientali ed endogene. Quando sono intensi, questi stimoli generano dolore acuto e, nel contesto di una lesione persistente, le componenti del sistema nervoso sia periferico che centrale del sistema di trasmissione del dolore mostrano una plasticità tremenda, aumentando i segnali del dolore e producendo ipersensibilità. Quando la plasticità facilita i riflessi protettivi, può essere utile, ma quando i cambiamenti persistono, può verificarsi una condizione di dolore cronico. Studi genetici, elettrofisiologici e farmacologici stanno chiarendo i meccanismi molecolari che sono alla base della rilevazione, della codifica e della modulazione di stimoli nocivi che generano dolore.
Introduzione: dolore acuto e persistente
La capacità di rilevare gli stimoli nocivi è essenziale per la sopravvivenza e il benessere di un organismo. Questo è drammaticamente illustrato dall'esame di individui che soffrono di anomalie congenite che li rendono incapaci di rilevare stimoli dolorosi. Queste persone non riescono a sentire il dolore penetrante da un oggetto appuntito, il calore di una fiamma aperta o persino il disagio associato a lesioni interne, come un osso rotto. Di conseguenza, non adottano comportamenti protettivi adeguati contro queste condizioni, molte delle quali possono essere pericolose per la vita.
Più comunemente, le alterazioni del percorso del dolore portano a un'ipersensibilità, tale che il dolore sopravvive alla sua utilità come sistema di allarme acuto e diventa invece cronico e debilitante. Questo può essere visto, ad un certo livello, come un'estensione del normale processo di guarigione, per cui i danni ai tessuti o ai nervi suscitano l'iperattività per promuovere la protezione dell'area ferita. Ad esempio, la solarizzazione produce sensibilizzazione temporanea dell'area interessata. Di conseguenza, normalmente stimoli innocui, come il tocco leggero o il calore, sono percepiti come dolorosi (un fenomeno indicato come allodinia), o normalmente stimoli dolorosi provocano dolore di maggiore intensità (denominata iperalgesia). Al suo estremo, la sensibilizzazione non si risolve. Infatti, le persone che soffrono di artrite, nevralgia post-erpetica (a seguito di un fuoco di Sant'Antonio), o cancro alle ossa, sperimentano un dolore intenso e spesso incessante che non è solo debilitante, fisiologicamente e psicologicamente, ma può anche ostacolare il recupero. Il dolore cronico può persistere anche a lungo dopo una lesione acuta, forse più comunemente come lombalgia o sciatica.
Sindromi persistenti o croniche del dolore possono essere iniziate o mantenute nei loci periferici e / o centrali. In entrambi i casi, la delucidazione delle molecole e dei tipi di cellule che sono alla base della normale sensazione di dolore (acuto) è fondamentale per comprendere i meccanismi alla base dell'ipersensibilità al dolore. Nella presente revisione si evidenzia la complessità molecolare delle fibre nervose afferenti primarie che rilevano stimoli nocivi. Non solo riassumiamo l'elaborazione del dolore acuto, ma descriviamo anche come i cambiamenti nell'elaborazione del dolore avvengono nel contesto di lesioni tissutali o nervose.
Le profonde differenze tra dolore acuto e dolore cronico enfatizzano il fatto che il dolore non è generato da un sistema immutabile e cablato, ma piuttosto dall'impegno di molecole e circuiti altamente plastici, le cui basi molecolari biochimiche e neuroanatomiche sono il fulcro del studi attuali. È importante sottolineare che questa nuova informazione ha identificato una serie di potenziali bersagli terapeutici per il trattamento del dolore. Ci concentriamo qui sui neuroni periferici e di secondo ordine nel midollo spinale; il lettore fa riferimento ad alcune eccellenti recensioni di meccanismi di elaborazione del dolore sovraspinale, che includono notevoli approfondimenti che gli studi di imaging hanno portato sul campo (Apkarian et al., 2005).
Panoramica anatomica
La nocicezione è il processo mediante il quale vengono rilevati intensi stimoli termici, meccanici o chimici da una sottopopolazione di fibre nervose periferiche, chiamate nocicettori (Basbaum e Jessell, 2000). I corpi cellulari dei nocicettori si trovano nei gangli della radice dorsale (DRG) per il corpo e nel ganglio del trigemino per la faccia e hanno un ramo assonale sia periferico che centrale che innerva rispettivamente il loro organo bersaglio e il midollo spinale. I nocicettori vengono eccitati solo quando le intensità dello stimolo raggiungono l'intervallo nocivo, suggerendo che possiedono proprietà biofisiche e molecolari che consentono loro di rilevare selettivamente e rispondere a stimoli potenzialmente dannosi. Esistono due classi principali di nocicettori. Il primo include afferenze mielinizzate (A?) di diametro medio che mediano il dolore acuto, ben localizzato o rapido. Queste afferenze mielinizzate differiscono considerevolmente dal diametro maggiore e conducono rapidamente A? fibre che rispondono a stimoli meccanici innocui (es. tocco leggero). La seconda classe di nocicettori comprende fibre a “C” non mielinizzate di piccolo diametro che trasmettono dolore scarsamente localizzato, “secondo” o lento.
Gli studi elettrofisiologici hanno ulteriormente suddiviso A? nocicettori in due classi principali. Il tipo I (HTM: nocicettori meccanici ad alta soglia) risponde a stimoli sia meccanici che chimici, ma ha soglie di calore relativamente elevate (>50°C). Se, tuttavia, lo stimolo termico viene mantenuto, queste afferenze risponderanno a temperature più basse. E, soprattutto, si sensibilizzeranno (cioè la soglia termica o meccanica diminuirà) nel contesto della lesione tissutale. Tipo II A? i nocicettori hanno una soglia di calore molto più bassa, ma una soglia meccanica molto alta. L'attività di questa afferente quasi certamente media la “prima” risposta dolorosa acuta al calore nocivo. Infatti, il blocco da compressione delle fibre nervose periferiche mielinizzate elimina il primo, ma non il secondo, dolore. Al contrario, la fibra di tipo I probabilmente media il primo dolore provocato da punture di spillo e altri intensi stimoli meccanici.
Anche le fibre C non mielinizzate sono eterogenee. Come le afferenze mielinizzate, la maggior parte delle fibre C è polimodale, cioè include una popolazione che è sia al calore che a sensibilità meccanica (CMHs) (Perl, 2007). Di particolare interesse sono gli afferenti non mielinizzati (i cosiddetti silenzi nocicettori), sensibili al calore, ma non sensibili alla meccanica che sviluppano la sensibilità meccanica solo nel contesto della lesione (Schmidt et al., 1995). Questi afferenti sono più sensibili agli stimoli chimici (capsaicina o istamina) rispetto ai CMH e probabilmente entrano in gioco quando l'ambiente chimico dell'infiammazione altera le loro proprietà. Le sottoreti di queste afferenze sono anche sensibili a una varietà di pruritogeni che producono prurito. Vale la pena notare che non tutte le fibre C sono nocicettori. Alcuni rispondono al raffreddamento, e una popolazione particolarmente interessante di afferenze non mielinizzate risponde ad un innocuo accarezzamento della pelle pelosa, ma non al calore o alla stimolazione chimica. Queste ultime fibre sembrano mediare un tocco piacevole (Olausson et al., 2008).
La caratterizzazione neuroanatomica e molecolare dei nocicettori ha ulteriormente dimostrato la loro eterogeneità, in particolare per le fibre C (Snider e McMahon, 1998). Ad esempio, la cosiddetta popolazione "peptidergica" di nocicettori C rilascia i neuropeptidi, la sostanza P e il peptide correlato al gene della calcitonina (CGRP); esprimono anche il recettore della neurotropina TrkA, che risponde al fattore di crescita del nervo (NGF). La popolazione non peptidergica dei nocicettori C esprime il recettore della neurotropina c-Ret che è bersaglio del fattore neurotrofico derivato dalla glia (GDNF), nonché della neurturina e dell'artemina. Una grande percentuale della popolazione c-Ret-positive lega anche l'isolectina IB4 ed esprime i recettori accoppiati alle proteine G della famiglia Mrg (Dong et al., 2001), così come specifici sottotipi di recettori purinergici, in particolare P2X3. I nocicettori possono anche essere distinti in base alla loro espressione differenziale di canali che conferiscono sensibilità al calore (TRPV1), freddo (TRPM8), ambiente acido (ASIC) e una serie di sostanze irritanti chimici (TRPA1) (Julius e Basbaum, 2001). Come indicato di seguito, queste classi di nocicettori, funzionalmente e molecolarmente eterogenee, si associano a una funzione specifica nella rilevazione di distinte modalità del dolore.
Il Nociceptor: una macchina di segnalazione bidirezionale
Si pensa generalmente che il nocicettivo porti informazioni in una direzione, trasmettendo stimoli nocivi dalla periferia al midollo spinale. Tuttavia, le fibre afferenti primarie hanno una morfologia unica, chiamata pseudo-unipolare, in cui entrambi i terminali centrale e periferico emanano da un gambo assonale comune. La maggior parte delle proteine sintetizzate dalla DRG o dalla cellula del ganglio trigeminale sono distribuite ai terminali sia centrale che periferico. Questo distingue il neurone afferente primario dal neurone prototipico, dove il ramo ricevente del neurone (la dendrite) è biochimicamente distinto dal ramo di trasmissione (l'assone). L'equivalenza biochimica dei terminali centrale e periferico significa che il nocicettore può inviare e ricevere messaggi da entrambe le estremità. Ad esempio, proprio come il terminale centrale è il locus di Ca2 + -dipendente rilascio di neurotrasmettitore, quindi il terminale periferico rilascia una varietà di molecole che influenzano l'ambiente del tessuto locale. L'infiammazione neurogena, infatti, si riferisce al processo mediante il quale il rilascio periferico dei neuropeptidi, CGRP e sostanza P, induce la vasodilatazione e lo stravaso delle proteine plasmatiche, rispettivamente (Basbaum e Jessell, 2000). Inoltre, mentre solo il terminale periferico del nocicettore risponde agli stimoli ambientali (calore doloroso, freddo e stimolazione meccanica), sia i terminali periferici che i terminali centrali possono essere presi di mira da una miriade di molecole endogene (come pH, lipidi e neurotrasmettitori) che regolano la sua sensibilità. Ne consegue che le terapie dirette a entrambi i terminali possono essere sviluppate per influenzare la trasmissione di messaggi di dolore. Ad esempio, il parto spinale (intratecale) della morfina colpisce i recettori oppioidi espressi dal terminale centrale dei nocicettori, mentre i farmaci applicati localmente (come anestetici locali o capsaicina) regolano il dolore attraverso un'azione al terminale periferico.
Proiezioni centrali del Nociceptor
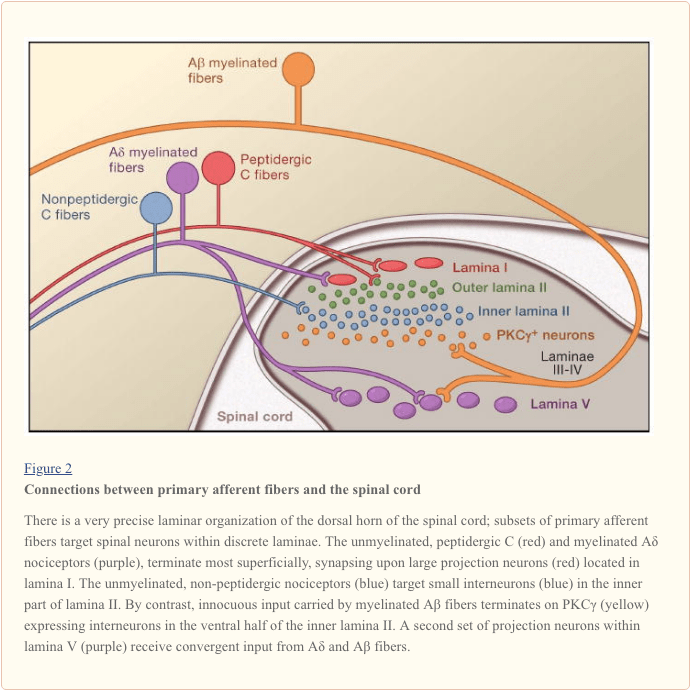
Le fibre nervose afferenti primarie proiettano al corno dorsale del midollo spinale, che è organizzato in lamine distinte anatomicamente ed elettrofisiologiche (Basbaum e Jessell, 2000) (Figura 1). Ad esempio, A? i nocicettori si proiettano sulla lamina I e sul corno dorsale più profondo (lamina V). La soglia bassa, che conduce rapidamente A? le afferenze, che rispondono al tocco leggero, proiettano sulle lamine profonde (III, IV e V). Al contrario, i nocicettori C proiettano più superficialmente sulle lamine I e II.
Questa notevole stratificazione di sottotipi afferenti all'interno del corno dorsale superficiale è ulteriormente evidenziata dai distinti modelli di proiezione dei nocicettori C (Snider e McMahon, 1998). Ad esempio, la maggior parte delle fibre C peptidergiche terminano all'interno della lamina I e nella parte più dorsale della lamina II. Al contrario, le afferenze non peptidergiche, incluso il sottogruppo che esprime Mrg, terminano nella regione centrale della lamina II. La parte più ventrale della lamina II è caratterizzata dalla presenza di interneuroni eccitatori che esprimono l'isoforma gamma della protein chinasi C (PKC), che è stata implicata nel dolore persistente indotto da lesioni (Malmberg et al., 1997). Studi recenti indicano che questo PKC? strato è mirato prevalentemente da afferenze non nocicettive mielinizzate (Neumann et al., 2008). Coerentemente con questi studi anatomici, le analisi elettrofisiologiche dimostrano che i neuroni del midollo spinale all'interno della lamina I sono generalmente sensibili alla stimolazione nociva (tramite fibre A? E C), i neuroni nelle lamine III e IV sono principalmente sensibili alla stimolazione innocua (tramite A?), E i neuroni nella lamina V ricevono un input convergente non nocivo e nocivo tramite A diretto (monosinaptico)? e A? ingressi e ingressi in fibra C indiretta (polisinaptica). Questi ultimi sono chiamati neuroni ad ampia gamma dinamica (WDR), in quanto rispondono a un'ampia gamma di intensità di stimolo. C'è anche comunemente un input viscerale a questi neuroni WDR, in modo tale che la risultante convergenza di somatico e viscerale contribuisca probabilmente al fenomeno del dolore riferito, per cui il dolore secondario a una lesione che colpisce un tessuto viscerale (ad esempio, il cuore nell'angina) è riferito a una struttura somatica (ad esempio, la spalla).
Vie ascendenti e elaborazione soprasparente del dolore
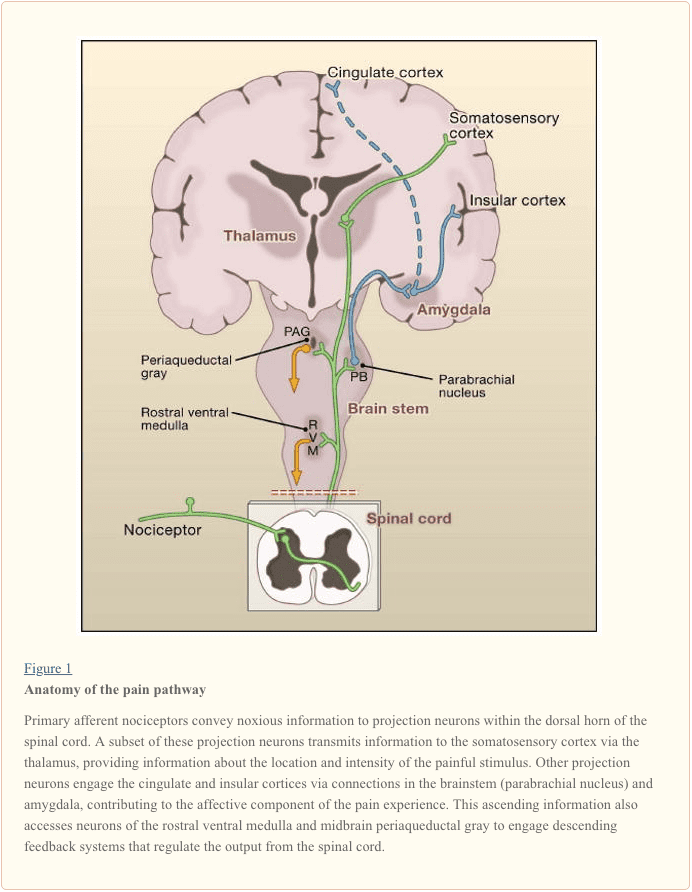
I neuroni di proiezione all'interno delle lamine I e V costituiscono l'output principale dal corno dorsale al cervello (Basbaum e Jessell, 2000). Questi neuroni sono all'origine di molteplici vie ascendenti, inclusi i tratti spinotalamico e spinoreticulotalamico, che trasmettono messaggi di dolore al talamo e al tronco cerebrale, rispettivamente (Figura 2). Il primo è particolarmente rilevante per gli aspetti sensoriali-discriminatori dell'esperienza del dolore (cioè, dove è lo stimolo e quanto è intenso?), Mentre quest'ultimo può essere più rilevante per i dolori mal localizzati. Più recentemente, l'attenzione si è concentrata sulle proiezioni del midollo spinale alla regione parabrachiale del ponte dorsolaterale, perché l'output di questa regione fornisce una connessione molto rapida con l'amigdala, una regione generalmente considerata per elaborare informazioni rilevanti per le proprietà avversive del dolore Esperienza.
Da questi loculi cerebrali e talamici, le informazioni raggiungono strutture corticali. Non esiste una singola area del cervello essenziale per il dolore (Apkarian et al., 2005). Piuttosto, il dolore deriva dall'attivazione di un gruppo distribuito di strutture, alcune delle quali sono più associate alle proprietà sensoriali-discriminatorie (come la corteccia somatosensoriale) e altre agli aspetti emotivi (come il giro cingolato anteriore e la corteccia insulare). Più recentemente, studi di imaging dimostrano l'attivazione di aree corticali prefrontali, nonché regioni non generalmente associate all'elaborazione del dolore (come i gangli della base e il cervelletto). Non è chiaro se e in che misura l'attivazione di queste regioni sia più correlata alla risposta dell'individuo allo stimolo o alla percezione del dolore. Infine, la Figura 2 illustra i potenti controlli discendenti che influenzano (sia in senso positivo che negativo) la trasmissione dei messaggi di dolore a livello del midollo spinale.
Dolore acuto
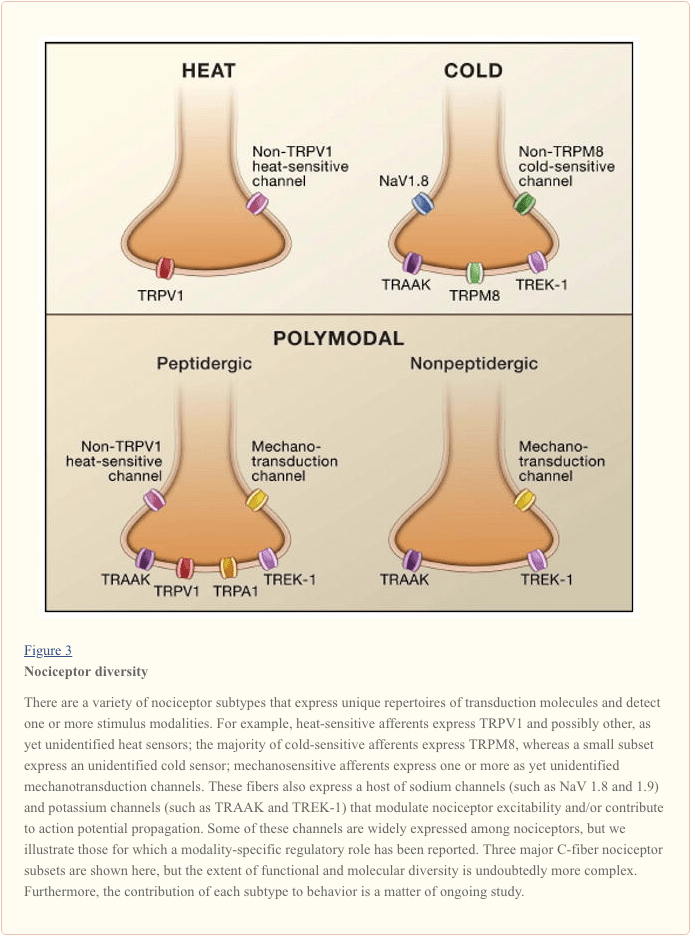
La fibra nervosa afferente primaria rileva gli stimoli ambientali (di natura termica, meccanica o chimica) e trasduce queste informazioni nel linguaggio del sistema nervoso, cioè la corrente elettrica. Innanzitutto, analizziamo i progressi nella comprensione delle basi molecolari della rilevazione del segnale, e seguiamo con una breve panoramica dei recenti studi genetici che evidenziano il contributo dei canali voltaggio-dipendenti alla trasmissione del dolore (Figura 3).
Attivando il Nociceptor: calore
Studi psicofisici umani hanno dimostrato che esiste una netta e riproducibile demarcazione tra la percezione del calore innocuo e quella nociva, che permette di riconoscere ed evitare temperature in grado di causare danni ai tessuti. Questa soglia del dolore, che in genere si ferma intorno ai 43°C, è parallela alla sensibilità al calore di C e di tipo II A? nocicettori descritti in precedenza. In effetti, i neuroni coltivati dai gangli della radice dorsale dissociati mostrano una sensibilità al calore simile. La maggior parte mostra una soglia di 43°C, con una coorte più piccola attivata da calore più intenso (soglia >50°C) (Cesare e McNaughton, 1996; Kirschstein et al., 1997; Leffler et al., 2007; Nagy e Rang , 1999). Approfondimenti molecolari sul processo della sensazione di calore sono venuti dalla clonazione e dalla caratterizzazione funzionale del recettore per la capsaicina, il principale ingrediente piccante nei peperoncini piccanti. La capsaicina e i relativi composti vanilloidi producono dolore bruciante depolarizzando specifici sottoinsiemi di C e A? nocicettori attraverso l'attivazione del recettore della capsaicina (o vanilloide), TRPV1, uno dei circa 30 membri della famiglia dei canali ionici del potenziale recettore transitorio maggiore (TRP) (Caterina et al., 1997). Il canale TRPV1 clonato è inoltre condizionato da incrementi della temperatura ambiente, con una soglia di attivazione termica (?43°C).
Diverse linee di evidenze supportano l'ipotesi che TRPV1 sia un trasduttore endogeno di calore nocivo. Innanzitutto, TRPV1 è espresso nella maggior parte dei nocicettori sensibili al calore (Caterina et al., 1997). In secondo luogo, le correnti capsaicina e quelle evocate dal calore sono simili, se non identiche, per quanto riguarda le loro proprietà farmacologiche e biofisiche, come quelle dei canali TRPV1 eterologicamente espressi. Terzo, e come descritto più dettagliatamente in seguito, le risposte evocate da TRPV1 sono marcatamente aumentate dagli agenti pro-algeici o pro-infiammatori (come i protoni extracellulari, le neurotrofine o la bradichinina), che producono tutti un'ipersensibilità al calore in vivo (Tominaga et al., 1998)). In quarto luogo, l'analisi dei topi privi di questo canale ionico non solo ha rivelato una perdita completa della sensibilità alla capsaicina, ma anche questi animali mostrano una significativa compromissione nella capacità di rilevare e reagire al calore nocivo (Caterina et al., 2000; Davis et al., 2000 ). Questi studi hanno anche dimostrato un ruolo essenziale per questo canale nel processo in cui la lesione tissutale e l'infiammazione portano a un'ipersensibilità al calore, riflettendo la capacità di TRPV1 di fungere da integratore molecolare di stimoli termici e chimici (Caterina et al., 2000; Davis et al ., 2000).
Il contributo di TRPV1 alla sensazione di calore acuto, tuttavia, è stato messo in discussione dai dati raccolti da una preparazione ex vivo in cui le registrazioni sono ottenute dal soma dei neuroni DRG con fibre intere centrali e periferiche. In uno studio, non sono state osservate differenze nelle risposte evocate dal calore di animali con carenza di TRPV1 e wild-type (Woodbury et al., 2004), ma un'analisi più recente da questo gruppo ha rilevato che i topi con deficienza di TRPV1 mancano effettivamente di un coorte di neuroni attivati con forza dal calore nocivo (Lawson et al., 2008). Presi insieme ai risultati sopra descritti, concludiamo che TRPV1 contribuisce indiscutibilmente alla sensazione di calore acuto, ma concordiamo sul fatto che TRPV1 non è il solo responsabile della trasduzione del calore.
A questo proposito, mentre i topi con deficit di TRPV1 mancano di un componente di sensibilità al calore comportamentale, l'uso di capsaicina ad alta dose per ablare i terminali centrali delle fibre afferenti primarie che esprimono TRPV1 si traduce in una più profonda, se non completa perdita di sensibilità acuta al dolore caldo (Cavanaugh et al., 2009). Per quanto riguarda il mutante TRPV1, c'è anche una perdita di iperalgesia da calore evocato da lesioni tissutali. Presi insieme questi risultati indicano che sia il componente TRPV1-dipendente che TRPV1-indipendente della sensibilità al calore nociva è mediato dai nocicettori che esprimono TRPV1.
Cosa spiega la componente TRPV1-indipendente della sensazione di calore? Un certo numero di altri sottotipi di canale TRPV, inclusi TRPV2, 3 e 4, sono emersi come trasduttori di calore candidati che potrebbero potenzialmente coprire il rilevamento delle intensità di stimolo che fiancheggiano quello di TRPV1, inclusi sia molto caldo (> 50 ° C) che caldo (metà 30 ° Cs) temperature (Lumpkin e Caterina, 2007). I canali TRPV2 espressi eterologicamente visualizzano una soglia di attivazione della temperatura di? 52 ° C, mentre TRPV3 e TRPV4 sono attivati tra 25 e 35 ° C. TRPV2 è espresso in una sottopopolazione di A? neuroni che rispondono al calore nocivo ad alta soglia e le sue proprietà biofisiche assomigliano a quelle delle correnti indotte dal calore ad alta soglia (Leffler et al., 2007; Rau et al., 2007). Finora, non ci sono rapporti pubblicati che descrivono test fisiologici o comportamentali dei topi knockout per TRPV2. D'altra parte, i topi carenti di TRPV3 e TRPV4 mostrano una preferenza termica alterata quando posti su una superficie di temperature graduate, suggerendo che questi canali contribuiscono in qualche modo alla rilevazione della temperatura in vivo (Guler et al., 2002). È interessante notare che sia TRPV3 che TRPV4 mostrano un'espressione sostanzialmente maggiore nei cheratinociti e nelle cellule epiteliali rispetto ai neuroni sensoriali, aumentando la possibilità che il rilevamento di stimoli termici innocui implichi un'interazione funzionale tra la pelle e le fibre afferenti primarie sottostanti (Chung et al., 2003; Peier et al., 2002b).
Attivando il Nociceptor: Cold
Per quanto riguarda la capsaicina e il TRPV1, agenti refrigeranti naturali, come mentolo ed eucaliptolo, sono stati sfruttati come sonde farmacologiche per identificare e caratterizzare fibre e cellule sensibili al freddo (Hensel e Zotterman, 1951; Reid e Flonta, 2001) e le molecole che stanno alla base il loro comportamento. Infatti, la maggior parte dei neuroni sensibili al freddo risponde al mentolo e mostra una soglia di attivazione termica di ?25°C. Il TRPM8 è un canale sensibile al freddo e al mentolo le cui caratteristiche fisiologiche corrispondono a quelle delle correnti fredde native e i topi carenti di TRPM8 mostrano una perdita molto sostanziale di mentolo e delle risposte evocate dal freddo a livello cellulare o delle fibre nervose. Allo stesso modo, questi animali mostrano gravi deficit nelle risposte comportamentali evocate dal freddo (Bautista et al., 2007; Colburn et al., 2007; Dhaka et al., 2007) in un'ampia gamma di temperature che vanno da 30 a 10°C. Come nel caso di TRPV1 e lui, i topi carenti di TRPM8 non sono completamente insensibili al freddo. Ad esempio, rimane una piccola coorte (?4%) di neuroni sensibili al freddo e insensibili al mentolo che hanno una bassa soglia di attivazione, di circa 12°C. Questi possono spiegare la sensibilità al freddo residua osservata nei test comportamentali, in cui gli animali carenti di TRPM8 possono ancora evitare superfici estremamente fredde al di sotto dei 10°C. È importante sottolineare che i topi carenti di TRPM8 mostrano una normale sensibilità al calore nocivo. In effetti, TRPV1 e TRPM8 sono espressi in popolazioni neuronali in gran parte non sovrapposte, coerenti con l'idea che i meccanismi di rilevamento del caldo e del freddo sono organizzati in "linee etichettate" anatomicamente e funzionalmente distinte.
Sulla base di sistemi di espressione eterologhi, TRPA1 è stato anche suggerito per rilevare il freddo, in particolare all'interno dell'intervallo nocivo (<15 ° C). Inoltre TRPA1 è attivato dai composti refrigeranti icilina e mentolo (Bandell et al., 2004; Karashima et al., 2007; Story et al., 2003), sebbene a concentrazioni relativamente elevate rispetto alle loro azioni a TRPM8. Tuttavia, continua ad esserci disaccordo sul fatto che TRPA1 nativo o ricombinante sia intrinsecamente sensibile al freddo (Bandell et al., 2004; Jordt et al., 2004; Karashima et al., 2009; Nagata et al., 2005; Zurborg et al. ., 2007). Questa controversia non è stata risolta dall'analisi di due linee di topi con deficit di TRPA1 indipendenti. A livello cellulare, uno studio ha mostrato normali risposte evocate dal freddo in neuroni con deficit di TRPA1 a seguito di un calo della temperatura di 30 secondi da 22 ° C a 4 ° C (Bautista et al., 2006); uno studio più recente ha mostrato una diminuzione dei neuroni sensibili al freddo dal 26% (WT) al 10% (TRPA1 - / -), quando testato dopo un calo di temperatura di 200 secondi, da 30 ° C a 10 ° C (Karashima et al ., 2009). Negli studi comportamentali, i topi carenti di TRPA1 mostrano risposte simili a lettiera wild-type nei saggi di raffreddamento evaporativo con piastra fredda e acetone (Bautista et al., 2006). Un secondo studio utilizzando gli stessi saggi ha mostrato che gli animali knockout per TRPA1 femmine, ma non maschi, mostravano una sensibilità al freddo attenuata rispetto ai cuccioli selvatici (Kwan et al., 2006). Karashima et al non hanno riscontrato differenze nelle latenze di tremore o ritiro della zampa in topi maschi o femmine con deficit di TRPA1 durante il test della piastra fredda, ma hanno osservato che l'esposizione prolungata alla superficie fredda provocava salti in animali selvatici, ma non carenti di TRPA1 (Karashima et al. al., 2009). In teoria, quest'ultimo fenotipo riflette un contributo di TRPA1 alla sensibilità al freddo nel contesto di lesioni tissutali, ma non al dolore acuto da freddo. Coerentemente con quest'ultima ipotesi, le registrazioni di singole fibre nervose non mostrano alcun decremento della sensibilità al freddo acuta nei topi con deficit di TRPA1 (Cavanaugh et al., 2009; Kwan et al., 2009). Infine, è degno di nota il fatto che i topi trattati con capsaicina privi dei terminali centrali delle fibre che esprimono TRPV1 mostrano risposte comportamentali intatte a stimoli freddi freddi e nocivi (Cavanaugh et al., 2009). Poiché TRPA1 è espresso in un sottoinsieme di neuroni positivi a TRPV1, ne consegue che TRPA1 non è richiesto per la normale sensibilità acuta al freddo. Studi futuri che utilizzano topi carenti sia per TRPM8 che per TRPA1 aiuteranno a risolvere questi problemi e a identificare le molecole e i tipi di cellule che sono alla base della componente residua indipendente da TRPM8 della sensibilità al freddo.
Ulteriori molecole, inclusi canali del sodio voltaggio-dipendenti (discussi di seguito), canali del potassio voltaggio-dipendenti e canali del potassio in KCNK a due pori, coordinati con TRPM8 per mettere a punto le soglie fredde o propagare potenziali d'azione evocati a freddo (Viana et al. , 2002; Zimmermann et al., 2007; Noel et al., 2009). Ad esempio, inibitori specifici di Kv1 aumentano la soglia di temperatura dei neuroni sensibili al freddo e l'iniezione di questi inibitori nella zampa posteriore del roditore riduce le risposte comportamentali al freddo, ma non al calore o agli stimoli meccanici (Madrid et al., 2009). Due membri della famiglia di canali KCNK, KCNK2 (TREK-1) e KCNK4 (TRAAK) sono espressi in un sottogruppo di nocicettori a fibra C (Noel et al., 2009) e possono essere modulati da numerosi stimoli fisiologici e farmacologici, inclusa la pressione e temperatura. Inoltre, i topi privi di questi canali mostrano anomalie nella sensibilità alla pressione, al caldo e al freddo (Noel et al., 2009). Sebbene questi risultati suggeriscano che i canali TREK-1 e TRAAK modulano l'eccitabilità nocicettiva, non è chiaro in che modo la loro intrinseca sensibilità agli stimoli fisici si riferisca al loro contributo in vivo alla trasduzione termica o meccanica.
Attivazione del Nociceptor: Mechanical
Il sistema somatosensoriale rileva stimoli meccanici quantitativamente e qualitativamente diversi, che vanno dal leggero sfioramento della pelle alla distensione della parete vescicale. Una varietà di sottotipi neuronali meccanosensibili sono specializzati per rilevare questa vasta gamma di stimoli meccanici e possono essere classificati in base alla sensibilità di soglia. I meccanocettori ad alta soglia includono le fibre C e l'adattamento lento di A? fibre dei meccanorecettori (AM), che terminano entrambe come terminazioni nervose libere nella pelle. I meccanocettori a bassa soglia includono A? Fibre di capelli D che terminano sui peli della pelle e rilevano il tocco leggero. Infine, A? le fibre che innervano le cellule di Merkel, i corpuscoli paciniani ei follicoli piliferi rilevano consistenza, vibrazioni e leggera pressione.
Come nel caso degli stimoli termici, la sensibilità meccanica è stata valutata a diversi livelli, inclusi neuroni sensoriali dissociati in coltura, registrazioni di fibre ex vivo, nonché registrazioni da centrali (cioè neuroni del corno dorsale) e misurazioni dell'output comportamentale. Le registrazioni del nervo cutaneo ex vivo sono state molto istruttive nell'abbinare le proprietà dello stimolo (come intensità, frequenza, velocità e adattamento) a specifici sottotipi di fibre. Ad esempio, A? le fibre sono principalmente associate alla sensibilità al tocco leggero, mentre C e A? le fibre sono principalmente sensibili agli insulti meccanici nocivi. A livello comportamentale, la sensibilità meccanica viene generalmente valutata utilizzando due tecniche. Il più comune riguarda la misurazione delle risposte riflesse alla forza costante applicata alla zampa posteriore del roditore da filamenti calibrati (peli di Von Frey). Il secondo applica una pressione crescente alla zampa o alla coda tramite un sistema di bloccaggio. In entrambi i casi, le informazioni sulle soglie meccaniche sono ottenute in situazioni normali (acute) o di lesioni (ipersensibilità). Una delle sfide in quest'area è stata quella di sviluppare ulteriori test comportamentali che misurino diversi aspetti della meccanosensazione, come la discriminazione della trama e la vibrazione, che faciliteranno lo studio del tocco nocivo e non nocivo (Wetzel et al., 2007).
A livello cellulare, la pressione può essere applicata ai corpi cellulari dei neuroni somatosensoriali colti (o ai loro neuriti) utilizzando una sonda di vetro, cambiamenti nella resistenza osmotica o stiramento tramite distensione di una superficie di coltura elastica, sebbene non sia chiaro quale stimolo sia il migliore imita la pressione fisiologica (Bhattacharya et al., 2008; Cho et al., 2006; Cho et al., 2002; Drew et al., 2002; Hu e Lewin, 2006; Lin et al., 2009; Takahashi e Gotoh, 2000 ). Le risposte possono essere valutate utilizzando metodi elettrofisiologici o di imaging cellulare dal vivo. Il consenso di tali studi è che tale pressione apre un canale cationico meccanosensibile per suscitare una rapida depolarizzazione. Tuttavia, la mancanza di specifiche sonde farmacologiche e di marcatori molecolari con cui caratterizzare queste risposte o di etichettare sottotipi neuronali rilevanti ha ostacolato i tentativi di abbinare le attività cellulari con sottoclassi di fibre nervose definite anatomicamente o funzionalmente. Queste limitazioni hanno anche impedito l'analisi molecolare della meccanosensazione e l'identificazione di molecole che costituiscono il meccanismo di meccanotrasduzione. Nondimeno, sono emersi numerosi candidati, basati in gran parte su studi di meccanosensazione in organismi genetici modello. Gli ortologhi dei mammiferi di queste proteine sono stati esaminati utilizzando approcci di targeting genico nei topi, in cui le tecniche sopra menzionate possono essere utilizzate per valutare i deficit nella meccanosensazione a tutti i livelli. Di seguito riassumiamo brevemente alcuni dei candidati rivelati in questi studi.
Candidate Mechanotransducers: DEG / ENaC Channels
Studi nel nematode Caenorhabditis elegans (C. elegans) hanno identificato mec-4 e mec-10, membri delle famiglie degenerina / epiteliale del canale Na + (DEG / ENaC), come meccanotrasduttori nei neuroni tattili del corpo (Chalfie, 2009). Sulla base di questi studi, gli ortologi dei mammiferi ASIC 1, 2 e 3 sono stati proposti come canali di meccanotrasduzione. Gli ASIC sono canali ionici sensibili agli acidi che fungono da recettori per i protoni extracellulari (acidosi tissutale) prodotti durante l'ischemia (vedi sotto). Sebbene questi canali siano espressi da neuroni meccanosensibili a bassa e alta soglia, gli studi genetici non supportano in modo uniforme un ruolo essenziale nella meccanotrasduzione. I topi privi di canali ASIC1 funzionali mostrano normali risposte comportamentali al tocco cutaneo, e poca o nessuna modifica nella sensibilità meccanica quando valutata mediante registrazione su singola fibra (Page et al., 2004; Price et al., 2000). Allo stesso modo, le fibre nervose periferiche da topi carenti di ASIC2 mostrano solo una leggera diminuzione del potenziale d'azione che spara agli stimoli meccanici, mentre le fibre carenti di ASIC3 mostrano un leggero aumento (nessuna variazione delle soglie meccaniche o sensibilità meccanica comportamentale di base è stata osservata in questi animali) ( Price et al., 2001; Roza et al., 2004). L'analisi dei topi carenti sia per ASIC2 che per ASIC3 non riesce a supportare un ruolo per questi canali nella meccanotrasduzione cutanea (Drew et al., 2004). Pertanto, anche se questi canali sembrano giocare un ruolo nel dolore muscolo-scheletrico e ischemico (vedi sotto), il loro contributo alla meccanosensazione rimane irrisolto.
Studi genetici suggeriscono che i canali di C. elegans mec-4 / mec-10 esistono in un complesso con la proteina simile alla stomatina MEC-2 (Chalfie, 2009). I topi privi dell'ortologo MEC-2, SLP3, mostrano una perdita di meccanosensibilità nella bassa soglia A? e A? fibre, ma non nelle fibre C (Wetzel et al., 2007). Questi topi mostrano un'acuità tattile alterata, ma mostrano risposte normali alla pressione nociva, suggerendo che SLP3 contribuisce alla rilevazione di stimoli meccanici innocui, ma non nocivi. Non è noto se SLP3 funzioni in un complesso di meccanotrasduzione o interagisca con ASIC nei neuroni sensoriali dei mammiferi.
Candidati Meccanotrasduttori: canali TRP
Come notato sopra, quando espresso in modo eterologo, TRPV2 non solo risponde al calore nocivo, ma anche all'allungamento osmotico. Inoltre, i canali nativi TRPV2 nelle cellule muscolari lisce vascolari sono attivati da aspirazione diretta e stimoli osmotici (Muraki et al., 2003). Un ruolo per TRPV2 per la meccanotrasduzione somatosensoriale in vivo non è stato ancora testato.
TRPV2 è espresso in modo robusto in diametro medio e grande, A? fibre che rispondono a stimoli sia meccanici che termici (Caterina et al., 1999; Muraki et al., 2003). TRPV4 mostra una modesta espressione nei gangli sensoriali, ma è più abbondantemente espresso nei reni e nelle cellule uroteliali sensibili allo stiramento della vescica (Gevaert et al., 2007; Mochizuki et al., 2009). Quando espressi eterologicamente, sia TRPV2 che TRPV4 hanno dimostrato di rispondere ai cambiamenti nella pressione osmotica (Guler et al., 2002; Liedtke et al., 2000; Mochizuki et al., 2009; Strotmann et al., 2000). L'analisi di animali carenti di TRPV4 suggerisce un ruolo nell'osmosensazione poiché gli animali knockout mostrano difetti nella pressione sanguigna, nel bilancio idrico e nella minzione della vescica (Gevaert et al., 2007; Liedtke e Friedman, 2003). Questi animali mostrano meccanosensazione cutanea acuta normale, ma mostrano deficit nei modelli di iperalgesia meccanica e termica (Alessandri-Haber et al., 2006; Chen et al., 2007; Grant et al., 2007; Suzuki et al., 2003). Pertanto, è improbabile che TRPV4 serva come meccanotrasduttore primario nei neuroni sensoriali, ma può contribuire all'ipersensibilità al dolore provocata da lesioni.
È stato anche proposto che TRPA1 funga da rilevatore di stimoli meccanici. Il TRPA1 di mammifero espresso in modo eterologo è attivato da membrane crenators (Hill e Schaefer, 2007) e l'ortologo del verme è sensibile alla pressione meccanica applicata tramite una pipetta di aspirazione (Kindt et al., 2007). Tuttavia, i topi con deficit di TRPA1 mostrano solo difetti deboli nel comportamento meccanosensoriale ei risultati sono incoerenti. Due studi non hanno riportato alcun cambiamento nelle soglie meccaniche in animali carenti di TRPA1 (Bautista et al., 2006; Petrus et al., 2007), mentre un terzo studio ha riportato deficit (Kwan et al., 2006). Uno studio più recente mostra che C e A? le fibre meccanosensibili negli animali knockout per TRPA1 hanno alterato le risposte alla stimolazione meccanica (alcune aumentate e altre diminuite) (Kwan et al., 2009). Non è chiaro se e come questi effetti fisiologici differenziali si manifestino a livello di comportamento. Presi insieme, TRPA1 non sembra funzionare come un rilevatore primario di stimoli meccanici acuti, ma forse modula l'eccitabilità delle afferenze meccanosensibili.
Candidati Meccanotrasduttori: canali KCNK
Oltre al potenziale ruolo di meccanotrasduttore di KCNK2 e 4 (vedi sopra), KCNK18 è stato discusso per il suo possibile contributo alla meccanosensazione. Pertanto, KCNK18 è preso di mira dall'idrossi-a-sanshool, l'ingrediente pungente dei grani di pepe di Sichuan che produce sensazioni di formicolio e intorpidimento, suggestive di un'interazione con i neuroni sensibili al tatto (Bautista et al., 2008; Bryant and Mezine, 1999; Sugai et al., 2005). KCNK18 è espresso in un sottoinsieme di presunte fibre C peptidergiche e meccanocettori a bassa soglia (A?), Dove funge da regolatore principale della durata del potenziale d'azione e dell'eccitabilità (Bautista et al., 2008; Dobler et al., 2007). Inoltre, sanshool depolarizza i neuroni sensoriali di grande diametro osmo- e meccanosensibili, nonché un sottoinsieme di nocicettori (Bautista et al., 2008; Bhattacharya et al., 2008). Sebbene non sia noto se KCNK18 sia direttamente sensibile alla stimolazione meccanica, può essere un regolatore critico dell'eccitabilità dei neuroni coinvolti nella sensazione tattile innocua o nociva.
In sintesi, la base molecolare della meccanotrasduzione dei mammiferi è lungi dall'essere chiarita. L'ipersensibilità meccanica in risposta a lesioni tissutali o nervose rappresenta un importante problema clinico e pertanto la spiegazione delle basi biologiche del contatto in condizioni normali e patofisiologiche rimane una delle principali sfide nella ricerca sul somatosensoriale e sul dolore.
Attivando il Nociceptor: Chemical
La chemio-nocicezione è il processo mediante il quale i neuroni afferenti primari rilevano le sostanze irritanti ambientali e i fattori endogeni prodotti dallo stress fisiologico. Nel contesto del dolore acuto, i meccanismi chemo-nocicettivi innescano risposte avversive a una varietà di sostanze irritanti ambientali. Anche qui, i canali TRP hanno ruoli importanti, forse non sorprendenti dato che funzionano come recettori per sostanze irritanti derivate dalle piante, tra cui la capsaicina (TRPV1), il mentolo (TRPM8), nonché gli ingredienti pungenti nelle piante di senape e aglio, isotiocianati e tiosolfati (TRPA1) (Bandell et al., 2004; Caterina et al., 1997; Jordt et al., 2004; McKemy et al., 2002; Peier et al., 2002a).
Per quanto riguarda gli irritanti ambientali, TRPA1 è emerso come un membro particolarmente interessante di questo gruppo. Questo perché TRPA1 risponde a composti strutturalmente diversi ma unificati nella loro capacità di formare addotti covalenti con gruppi tiolici. Ad esempio, allil isotiocianato (da wasabi) o allicina (da aglio) sono elettrofili permeabili alla membrana che attivano TRPA1 modificando covalentemente i residui di cisteina all'interno del dominio citoplasmatico ammino-terminale del canale (Hinman et al., 2006; Macpherson et al. 2007). Il modo in cui questo promuove il gating del canale è attualmente sconosciuto. Tuttavia, stabilire semplicemente l'importanza della reattività del tiolo in questo processo ha implicato il TRPA1 come obiettivo fisiologico chiave per un gruppo ampio e chimicamente diversificato di sostanze tossiche ambientali. Un esempio degno di nota è l'acroleina (2-propenale), un'aldeide insatura, altamente reattiva presente nei gas lacrimogeni, nei gas di scarico dei veicoli o nel fumo della vegetazione in fiamme (ad es. Incendi boschivi e sigarette). L'acroleina e altri irritanti volatili (come ipoclorito, perossido di idrogeno, formalina e isocianati) attivano i neuroni sensoriali che innervano gli occhi e le vie respiratorie, producendo dolore e infiammazione (Bautista et al., 2006; Bessac e Jordt, 2008; Caceres et al. , 2009). Questa azione può avere conseguenze particolarmente disastrose per chi soffre di asma, tosse cronica o altri disturbi polmonari. I topi privi di TRPA1 mostrano una sensibilità notevolmente ridotta a tali agenti, sottolineando la natura critica di questo canale come rilevatore sensoriale di sostanze irritanti ambientali reattive (Caceres et al., 2009). Oltre a queste tossine ambientali, TRPA1 è preso di mira da alcuni anestetici generali (come l'isofluorano) o sottoprodotti metabolici di agenti chemioterapici (come la ciclofosfamide), che probabilmente sono alla base di alcuni degli effetti collaterali negativi di questi farmaci, tra cui dolore acuto e forte neuroinfiammazione (Bautista et al., 2006; Matta et al., 2008).
Infine, gli agenti irritanti chimici e altri agenti pro-algesici sono prodotti anche in modo endogeno in risposta al danno tissutale o allo stress fisiologico, incluso lo stress ossidativo. Tali fattori possono agire da soli, o in combinazione, per sensibilizzare i nocicettori a stimoli termici e / o meccanici, riducendo così le soglie del dolore. Il risultato di questa azione è aumentare la protezione e i riflessi protettivi all'indomani della lesione. Pertanto, la chemio-nocicezione rappresenta un'importante interfaccia tra il dolore acuto e il dolore persistente, specialmente nel contesto della lesione e dell'infiammazione dei tessuti periferici, come discusso più dettagliatamente in seguito.
Dolore acuto: conduzione del segnale del dolore
Una volta che i segnali termici e meccanici sono trasdotti dal terminale afferente primario, il potenziale del recettore attiva una varietà di canali ionici voltaggio-dipendenti. I canali voltaggio-dipendenti di sodio e potassio sono fondamentali per la generazione di potenziali d'azione che trasmettono i segnali nocicettori alle sinapsi nel corno dorsale. I canali del calcio voltaggio-dipendenti svolgono un ruolo chiave nel rilascio di neurotrasmettitore dai terminali nocicettori centrali o periferici per generare rispettivamente dolore o infiammazione neurogena. Limitiamo la nostra discussione ai membri delle famiglie di canali del sodio e del calcio che fungono da bersagli dei farmaci analgesici attualmente usati o per i quali la genetica umana supporta un ruolo nella trasmissione del dolore. Una recente revisione ha discusso l'importante contributo dei canali del potassio KCNQ, incluso il beneficio terapeutico dell'aumento dell'attività del canale K + per il trattamento del dolore persistente (Brown e Passmore, 2009).
Canali di sodio voltaggio-dipendenti
Una varietà di canali del sodio sono espressi in neuroni somatosensoriali, inclusi i canali sensibili alla tetrodotossina (TTX) Nav1.1, 1.6 e 1.7, e i canali non sensibili al TTX, Nav1.8 e 1.9. Negli ultimi anni, il contributo di Nav1.7 ha ricevuto molta attenzione, poiché l'attività alterata di questo canale porta a una varietà di disturbi del dolore umano (Cox et al., 2006; Dib-Hajj et al., 2008). I pazienti con mutazioni con perdita di funzione all'interno di questo gene non sono in grado di rilevare stimoli nocivi e, di conseguenza, subiscono lesioni a causa della mancanza di riflessi protettivi. Al contrario, un numero di mutazioni gain-of-function in Nav1.7 porta ad ipereccitabilità del canale e sono associate a due distinti disturbi del dolore nell'uomo, eritromelalgia e disturbo parossistico estremo del dolore, che causano entrambe intense sensazioni di bruciore (Estacion et al. ., 2008; Fertleman et al., 2006; Yang et al., 2004). Studi su animali hanno dimostrato che Nav1.7 è altamente sovraregolato in una varietà di modelli di dolore infiammatorio. Infatti, l'analisi dei topi privi di Nav1.7 nei nocicettori C supporta un ruolo chiave per questo canale nell'ipersensibilità meccanica e termica dopo l'infiammazione e nelle risposte acute a stimoli meccanici nocivi (Nassar et al., 2004). Sorprendentemente, il dolore indotto dalle lesioni nervose è inalterato, suggerendo che i sottotipi del canale del sodio distinti, o un'altra popolazione di afferenti che esprimono Nav1.7, contribuiscono al dolore neuropatico (Nassar et al., 2005).
Il canale del sodio Nav1.8 è anche molto espresso dalla maggior parte dei nocicettori C. Come con gli animali knockout Nav1.7, quelli che mancano di Nav1.8 mostrano deficit modesti nella sensibilità al calore innocuo o nocivo o pressione innocua; tuttavia, mostrano risposte attenuate a stimoli meccanici nocivi (Akopian et al., 1999). Nav1.8 è anche richiesto per la trasmissione di stimoli freddi, in quanto i topi privi di questo canale sono insensibili al freddo in un ampio intervallo di temperature (Zimmermann et al., 2007). Questo perché Nav1.8 è unico tra i canali di sodio sensibili alla tensione in quanto non si disattiva a basse temperature, rendendolo il principale generatore di potenziali d'azione in condizioni di freddo.
È interessante notare che topi transgenici privi del sottoinsieme di neuroni sensoriali Nav1.8, che sono stati cancellati dall'espressione mirata della tossina difterica A (Abrahamsen et al., 2008), mostrano risposte attenuate sia agli stimoli meccanici sia al freddo a bassa e alta soglia. Inoltre, l'ipersensibilità meccanica e termica nei modelli di dolore infiammatorio è gravemente attenuata. I fenotipi differenziali di topi privi di canali Nav1.8 rispetto alla cancellazione dei neuroni che esprimono Nav1.8 presumibilmente riflettono il contributo di più sottotipi di canali di sodio voltaggio-dipendenti alla trasmissione di messaggi di dolore.
I canali del sodio voltaggio-dipendenti sono bersagli dei farmaci anestetici locali, evidenziando il potenziale per lo sviluppo di analgesici sottotipo-specifici. Nav1.7 è un obiettivo particolarmente interessante per il trattamento delle sindromi dolorose infiammatorie, in parte, perché gli studi genetici umani suggeriscono che gli inibitori Nav1.7 dovrebbero ridurre il dolore senza alterare altri processi fisiologici essenziali (vedi sopra). Un'altra potenziale applicazione di bloccanti del canale del sodio potrebbe essere quella di trattare l'estrema ipersensibilità al freddo, un effetto collaterale avverso particolarmente problematico dei chemioterapici a base di platino, come l'oxaliplatino (Attal et al., 2009). Gli antagonisti Nav1.8 (o TRPM8) possono alleviare questo o altre forme di allodinia fredda. Infine, la grande utilità degli antidepressivi inibitori della ricaptazione della serotonina e della norepinefrina per il trattamento del dolore neuropatico può, in effetti, risultare dalla loro capacità di bloccare i canali del sodio voltaggio-dipendenti (Dick et al., 2007).
Canali al calcio voltaggio-dipendenti
Una varietà di canali del calcio voltaggio-dipendenti sono espressi nei nocicettori. I canali del calcio di tipo N, P / Q e T hanno ricevuto la massima attenzione. I canali di tipo P / Q sono espressi ai terminali sinaptici nelle lamine II-IV del corno dorsale. Il loro ruolo esatto nella nocicezione non è completamente risolto. Tuttavia, le mutazioni in questi canali sono state collegate all'emicrania emiplegica familiare (de Vries et al., 2009). I canali del calcio di tipo N e T sono espressi anche dalle fibre C e sono sovraregolati in stati fisiopatologici, come nei modelli di neuropatia diabetica o dopo altre forme di lesione nervosa. Gli animali privi di Cav2.2 o 3.2 mostrano una ridotta sensibilizzazione agli stimoli meccanici o termici a seguito di infiammazione o lesione nervosa, rispettivamente (Cao, 2006; Swayne e Bourinet, 2008; Zamponi et al., 2009; Messinger et al., 2009). Inoltre, la? -Conotossina GVIA, che blocca i canali di tipo N, viene somministrata per via intratecale (come ziconotide) per fornire sollievo al dolore da cancro intrattabile (Rauck et al., 2009).
Tutti i canali del calcio sono proteine eteromeriche composte da subunità formanti pori? 1 e subunità modulatorie? 2 ?,? 2? o? 2 ?. Il? 2? la subunità regola la densità di corrente e la cinetica di attivazione e inattivazione. Nei nocicettori C, il? 2? la subunità è drammaticamente sovraregolata a seguito di lesioni nervose e svolge un ruolo chiave nell'ipersensibilità e nell'allodinia provocate da lesioni (Luo et al., 2001). In effetti, questa subunità è il bersaglio della classe di anticonvulsivanti gabapentinoidi, che sono ora ampiamente utilizzati per trattare il dolore neuropatico (Davies et al., 2007).
Dolore persistente: meccanismi periferici
Il dolore persistente associato a lesioni o malattie (come diabete, artrite o crescita tumorale) può derivare da alterazioni delle proprietà dei nervi periferici. Ciò può verificarsi come conseguenza del danneggiamento delle fibre nervose, con conseguente aumento del fuoco spontaneo o alterazioni della loro conduzione o delle proprietà dei neurotrasmettitori. In effetti, l'utilità di anestetici locali topici e anche sistemici per il trattamento di diverse condizioni di dolore neuropatico (come la nevralgia posterpetica) probabilmente riflette la loro azione sui canali del sodio che si accumulano nelle fibre nervose ferite.
Il milieu chimico di infiammazione
La sensibilizzazione periferica deriva più comunemente dai cambiamenti associati all'infiammazione nell'ambiente chimico della fibra nervosa (McMahon et al., 2008). Pertanto, il danno tissutale è spesso accompagnato dall'accumulo di fattori endogeni rilasciati da nocicettori attivati o cellule non neurali che risiedono all'interno o si infiltrano nella zona lesa (inclusi mastociti, basofili, piastrine, macrofagi, neutrofili, cellule endoteliali, cheratinociti e fibroblasti). Collettivamente. questi fattori, indicati come "zuppa infiammatoria", rappresentano una vasta gamma di molecole di segnalazione, inclusi neurotrasmettitori, peptidi (sostanza P, CGRP, bradichinina), eicosinoidi e lipidi correlati (prostaglandine, trombossani, leucotrieni, endocannabinoidi), neurotrofine, citochine e chemochine, oltre a proteasi e protoni extracellulari. Sorprendentemente, i nocicettori esprimono uno o più recettori della superficie cellulare in grado di riconoscere e rispondere a ciascuno di questi agenti pro-infiammatori o pro-algesici (Figura 4). Tali interazioni aumentano l'eccitabilità della fibra nervosa, aumentando così la sua sensibilità alla temperatura o al tatto.
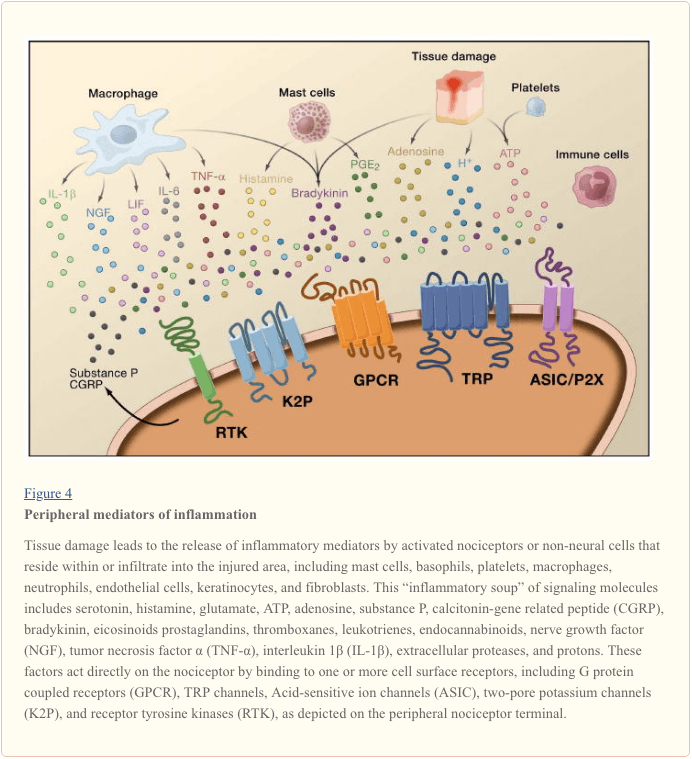
Indiscutibilmente l'approccio più comune per ridurre il dolore infiammatorio comporta l'inibizione della sintesi o dell'accumulo di componenti del brodo infiammatorio. Questo è meglio esemplificato da farmaci antinfiammatori non steroidei, come l'aspirina o l'ibuprofene, che riducono il dolore infiammatorio e l'iperalgesia inibendo le cicloossigenasi (Cox-1 e Cox-2) coinvolte nella sintesi delle prostaglandine. Un secondo approccio consiste nel bloccare le azioni degli agenti infiammatori al nocicettore. Qui, evidenziamo esempi che forniscono nuove informazioni sui meccanismi cellulari di sensibilizzazione periferica o che costituiscono la base di nuove strategie terapeutiche per il trattamento del dolore infiammatorio.
L'NGF è forse meglio conosciuto per il suo ruolo come fattore neurotrofico necessario per la sopravvivenza e lo sviluppo dei neuroni sensoriali durante l'embriogenesi, ma nell'adulto, NGF è anche prodotto nel contesto di danno tissutale e costituisce una componente importante del brodo infiammatorio (Ritner et al., 2009). Tra i suoi numerosi bersagli cellulari, NGF agisce direttamente sui nocicettori della fibra C peptidergici, che esprimono la tirosin-chinasi del recettore NGF ad alta affinità, TrkA, così come il recettore della neurotropina a bassa affinità, p75 (Chao, 2003; Snider and McMahon, 1998). NGF produce una profonda ipersensibilità al calore e agli stimoli meccanici attraverso due meccanismi distinti temporalmente. Inizialmente, un'interazione NGF-TrkA attiva le vie di segnalazione a valle, tra cui la fosfolipasi C (PLC), la chinasi proteica attivata dal mitogeno (MAPK) e il fosfoinositide 3-chinasi (PI3K). Ciò si traduce in un potenziamento funzionale delle proteine bersaglio nel terminale periferico dei nocicettori, in particolare TRPV1, che porta a un rapido cambiamento della sensibilità al calore cellulare e comportamentale (Chuang et al., 2001). Oltre a queste azioni rapide, NGF viene anche trasportato retrogradamente nel nucleo del nocicettore, dove promuove l'aumentata espressione di proteine pro-nocicettive, tra cui la sostanza P, TRPV1 e la subunità del canale del sodio voltaggio-dipendente Nav1.8 (Chao, 2003; Ji et al., 2002). Insieme, questi cambiamenti nell'espressione genica aumentano l'eccitabilità del nocicettore e amplificano la risposta infiammatoria neurogena.
Oltre alle neurotrofine, la lesione promuove il rilascio di numerose citochine, la principale tra cui l'interleuchina 1? (IL-1?) E IL-6 e fattore di necrosi tumorale? (TNF-?) (Ritner et al., 2009). Sebbene ci siano prove a sostegno di un'azione diretta di queste citochine sui nocicettori, il loro contributo primario all'ipersensibilità al dolore deriva dal potenziamento della risposta infiammatoria e dall'aumento della produzione di agenti pro-algesici (come prostaglandine, NGF, bradichinina e protoni extracellulari).
Indipendentemente dai loro meccanismi pro-nocicettivi, l'interferenza con la segnalazione di neurotrofine o citochine è diventata una strategia importante per il controllo della malattia infiammatoria o del dolore risultante. L'approccio principale prevede il blocco di NGF o TNF-? azione con un anticorpo neutralizzante. Nel caso del TNF-?, Questo è stato notevolmente efficace nel trattamento di numerose malattie autoimmuni, inclusa l'artrite reumatoide, portando a una drastica riduzione sia della distruzione dei tessuti che dell'iperalgesia di accompagnamento (Atzeni et al., 2005). Poiché le principali azioni dell'NGF sul nocicettore adulto si verificano nel contesto dell'infiammazione, il vantaggio di questo approccio è che l'iperalgesia diminuirà senza influenzare la normale percezione del dolore. Infatti, gli anticorpi anti-NGF sono attualmente in sperimentazione clinica per il trattamento delle sindromi dolorose infiammatorie (Hefti et al., 2006).
Obiettivi della zuppa infiammatoria
TRPV1. La forte ipersensibilità al calore può svilupparsi con l'infiammazione o dopo l'iniezione di componenti specifici del brodo infiammatorio (come bradykinin o NGF). La mancanza di tale sensibilizzazione nei topi con deficit di TRPV1 fornisce supporto genetico all'idea che TRPV1 sia un componente chiave del meccanismo attraverso il quale l'infiammazione produce iperalgesia termica (Caterina et al., 2000; Davis et al., 2000). Infatti, studi in vitro hanno dimostrato che TRPV1 funziona come un integratore di segnale polimodale la cui sensibilità termica può essere profondamente modulata dai componenti del brodo infiammatorio (Tominaga et al., 1998). Alcuni di questi agenti infiammatori (ad esempio, protoni extracellulari e lipidi) funzionano come modulatori allosterici positivi diretti del canale, mentre altri (bradichinina, ATP e NGF) si legano ai loro recettori su afferenti primari e modulano TRPV1 attraverso l'attivazione di intracellulare a valle percorsi di segnalazione. In entrambi i casi, queste interazioni determinano una profonda diminuzione della soglia di attivazione termica del canale, nonché un aumento dell'ampiezza delle risposte a temperature al di sopra della soglia - gli equivalenti biofisici di allodinia e iperalgesia, rispettivamente.
Tuttavia, permangono controversie riguardo ai meccanismi di segnalazione intracellulari più responsabili della modulazione TRPV1 (Lumpkin e Caterina, 2007). Ricordando i canali ancestrali TRP nell'occhio di mosca, molti canali TRP dei mammiferi sono attivati o modulati positivamente dalla scissione della fosfolipasi mediata da C di fosfatidil fosfatidil inositolo 4,5 bisfosfato (PIP2). Naturalmente, ci sono molte conseguenze a valle di questa azione, inclusa una diminuzione della membrana PIP2, aumento dei livelli di diacilglicerolo e dei suoi metaboliti, aumento del calcio citoplasmatico e conseguente attivazione delle protein chinasi. Nel caso di TRPV1, la maggior parte, se non tutti, di questi percorsi sono stati implicati nel processo di sensibilizzazione e rimane da vedere quali sono i più rilevanti per l'ipersensibilità termica comportamentale. Tuttavia, vi è ampio consenso sul fatto che la modulazione TRPV1 sia rilevante per l'ipersensibilità al dolore evocato da lesioni tissutali, in particolare nel contesto dell'infiammazione. Ciò includerebbe condizioni quali scottature solari, infezioni, reumatoidi o artrosi e malattie infiammatorie delle ciotole. Un altro esempio interessante include il dolore da cancro alle ossa (Honore et al., 2009), dove la crescita del tumore e la distruzione ossea sono accompagnate da un'acidosi tissutale estremamente robusta, così come dalla produzione di citochine, neurotrofine e prostaglandine.
TRPA1. Come descritto sopra, TRPA1 è attivato da composti che formano addotti covalenti con residui di cisteina. Oltre alle tossine ambientali, questo include elettrofili reattivi ai tioli endogeni prodotti durante lesioni e infiammazioni dei tessuti o come conseguenza di stress ossidativo o nitrativo. I principali tra questi agenti sono il 4-idrossi-2-nonenale e il 15-deossi-? 12,14-prostaglandina J2, che sono entrambi?,? aldeidi insature generate attraverso perossidazione o disidratazione spontanea di secondi messaggeri lipidici (Andersson et al., 2008; Cruz-Orengo et al., 2008; Materazzi et al., 2008; Trevisani et al., 2007). Altri agonisti TRPA1 endogeni includono acido nitrooleico, perossido di idrogeno e idrogeno solforato. Oltre a questi agenti ad azione diretta, TRPA1 è anche modulato indirettamente da agenti pro-algesici, come la bradichinina, che agiscono tramite recettori accoppiati a PLC. Infatti, i topi carenti di TRPA1 mostrano risposte cellulari e comportamentali drasticamente ridotte a tutti questi agenti, così come una riduzione dell'ipersensibilità termica e meccanica provocata da lesioni tissutali (Bautista et al., 2006; Kwan et al., 2006). Infine, poiché TRPA1 svolge un ruolo chiave nelle risposte neurogeniche e di altre infiammazioni sia agli agenti endogeni che alle tossine ambientali volatili, il suo contributo all'infiammazione delle vie aeree, come avviene nell'asma, è di particolare interesse. Infatti, il blocco genetico o farmacologico di TRPA1 riduce l'infiammazione delle vie aeree in un modello di roditore di asma evocato da allergeni (Caceres et al., 2009).
ASIC. Come notato sopra, i canali ASIC sono membri della famiglia DEG / ENaC che vengono attivati dall'acidificazione e rappresentano quindi un altro sito importante per l'azione dei protoni extracellulari prodotti come conseguenza di lesioni tissutali o stress metabolico. I sottotipi ASIC possono formare una varietà di canali omerici o eteromerici, ciascuno con una sensibilità al pH e un profilo di espressione distinti. I canali contenenti il sottotipo ASIC3 sono specificamente espressi dai nocicettori e particolarmente ben rappresentati nelle fibre che innervano il muscolo scheletrico e cardiaco. In questi tessuti, il metabolismo anaerobico porta all'accumulo di acido lattico e protoni, che attivano i nocicettori per generare dolore muscolo-scheletrico o cardiaco (Immke e McCleskey, 2001). È interessante notare che i canali contenenti ASIC3 si aprono in risposta alla modesta diminuzione del pH (ad es. 7.4 a 7.0) che si verifica con ischemia cardiaca (Yagi et al., 2006). L'acido lattico potenzia inoltre significativamente il gating evocato dal protone attraverso un meccanismo che coinvolge la chelazione del calcio (Immke e McCleskey, 2003). Pertanto, i canali contenenti ASIC3 rilevano e integrano i segnali specificamente associati all'ischemia muscolare e, in questo modo, sono funzionalmente distinti dagli altri sensori acidi sul primario afferente, come TRPV1 o altri sottotipi di canali ASIC.
Dolore persistente: meccanismi centrali
La sensibilizzazione centrale si riferisce al processo attraverso il quale uno stato di ipereccitabilità è stabilito nel sistema nervoso centrale, portando a un miglioramento dell'elaborazione dei messaggi nocicettivi (dolore) (Woolf, 1983). Sebbene numerosi meccanismi siano stati implicati nella sensibilizzazione centrale, qui ci concentriamo su tre: alterazione della neurotrasmissione glutammatergica / ipersensibilità mediata dal recettore NMDA, perdita di controlli inibitori tonico (disinibizione) e interazioni gliali-neuronali (Figura 5).
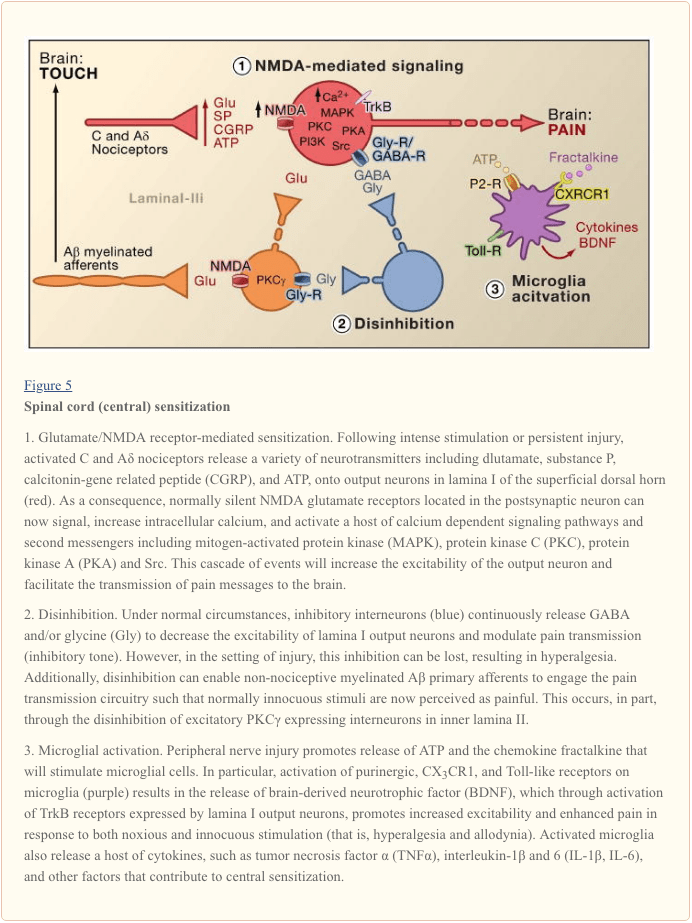
Sensibilizzazione mediata dal recettore glutammato / NMDA
Il dolore acuto è segnalato dal rilascio di glutammato dai terminali centrali dei nocicettori, generando correnti eccitatorie post-sinaptiche (EPSC) in neuroni del corno dorsale di secondo ordine. Ciò si verifica principalmente attraverso l'attivazione di AMPA postsinaptici e sottotipi di kainato di recettori del glutammato ionotropico. La sommatoria degli EPSC sub-soglia nel neurone postsinaptico finirà per provocare un potenziale di azione e la trasmissione del messaggio del dolore ai neuroni di ordine superiore. In queste condizioni, il sottotipo NMDA del canale glutammato è silenzioso, ma nel contesto della lesione, l'aumento del rilascio di neurotrasmettitori dai nocicettori depolarizzerà sufficientemente i neuroni postsinaptici per attivare i recettori NMDA quiescenti. Il conseguente aumento di afflusso di calcio può rafforzare le connessioni sinaptiche tra i nocicettori e i neuroni di trasmissione del dolore del corno dorsale, che a loro volta esacerbano le risposte agli stimoli nocivi (cioè generano iperalgesia).
In molti modi, questo processo è paragonabile a quello implicato nei cambiamenti plastici associati al potenziamento a lungo termine dell'ippocampo (LTP) (per una revisione dell'LTP nel percorso del dolore, vedi Drdla e Sandkuhler, 2008). Infatti, i farmaci che bloccano la LTP spinale riducono l'iperalgesia indotta da lesioni tissutali. Come nel caso dell'LTP ippocampale, la sensibilizzazione centrale del midollo spinale dipende dagli aumenti mediati da NMDA del Ca2 + citosolico nel neurone postsinaptico. L'attivazione concomitante del glutammato metabotropico e dei recettori della sostanza P sul neurone postsinaptico può anche contribuire alla sensibilizzazione aumentando il calcio citosolico. L'attivazione a valle di un host di percorsi di segnalazione e sistemi di messaggistica secondari, in particolare le chinasi (come MAPK, PKA, PKC, PI3K, Src), aumenta ulteriormente l'eccitabilità di questi neuroni, in parte modulando la funzione del recettore NMDA (Latremoliere e Woolf, 2009) . Illustrativo di questo modello è la dimostrazione che le iniezioni spinali di un frammento peptidico di nove aminoacidi di Src non solo interrompono un'interazione recettore NMDA-Src ma anche diminuiscono marcatamente l'ipersensibilità prodotta dalla lesione periferica, senza modificare il dolore acuto. I topi nod mutanti di Src mostrano anche una ridotta allodinia meccanica dopo lesione del nervo (Liu et al., 2008).
Oltre a migliorare gli input dal sito della lesione (iperalgesia primaria), la sensibilizzazione centrale contribuisce alla condizione in cui la stimolazione innocua delle aree circostanti il sito della lesione può produrre dolore. Questa iperalgesia secondaria coinvolge la facilitazione eterosinaptica, in cui gli input da A? le afferenze, che normalmente rispondono al tocco leggero, ora attivano i circuiti di trasmissione del dolore, con conseguente allodinia meccanica profonda. Il fatto che il blocco di compressione delle fibre nervose periferiche interrompa contemporaneamente la conduzione in A? afferisce ed elimina l'iperalgesia secondaria indica che questi circuiti anormali sono stabiliti in contesti clinici così come in modelli animali (Campbell et al., 1988).
Perdita di controlli GABAergici e glicinergici: disinibizione
Gli interneuroni inibitori gABergergici o glicinergici sono densamente distribuiti nel corno dorsale superficiale e sono alla base della teoria del dolore a lungo termine del controllo del gate, che postula che la perdita di funzione di questi interneuroni inibitori (disinibizione) provocherebbe un aumento del dolore (Melzack e Wall, 1965). Infatti, nei roditori, la somministrazione spinale di antagonisti del recettore GABA (bicucullina) o glicina (stricnina) (Malan et al., 2002; Sivilotti e Woolf, 1994; Yaksh, 1989) produce un'ipersensibilità comportamentale simile a quella osservata dopo un danno periferico. Coerentemente con queste osservazioni, la lesione periferica porta ad una diminuzione delle correnti postsinaptiche inibitori nei neuroni superficiali del dorso del corno. Sebbene Moore et al. (2002) ha suggerito che la disinibizione deriva dalla morte indotta da lesioni dei nervi periferici degli interneuroni GABAergici, questa affermazione è stata contestata (Polgar et al., 2005). Indipendentemente dall'eziologia, l'inibizione tonica ridotta diminuisce la depolarizzazione e l'eccitazione dei neuroni di proiezione. Per quanto riguarda la sensibilizzazione centrale mediata da NMDA, la disinibizione migliora l'uscita del midollo spinale in risposta alla stimolazione dolorosa e non dolorosa, contribuendo all'allodinia meccanica (Keller et al., 2007; Torsney e MacDermott, 2006).
A seguito di un precedente rapporto che la delezione del gene che codifica per PKC? nel topo porta ad una marcata diminuzione dell'ipersensibilità meccanica evocata da lesioni nervose (Malmberg et al., 1997), studi recenti affrontano il coinvolgimento di questi neuroni nel processo disinibitorio. Pertanto, dopo il blocco dell'inibizione glicinergica con la stricnina, lo spazzolamento innocuo della zampa posteriore attiva gli interneuroni PKC-positivi nella lamina II (Miraucourt et al., 2007), così come i neuroni di proiezione nella lamina I. il midollo spinale si trovano solo nella parte più interna della lamina II (Figura 1), ne consegue che questi neuroni sono essenziali per l'espressione del dolore persistente evocato da lesioni nervose e che i meccanismi disinibitori portano alla loro iperattivazione.
Altri studi indicano che i cambiamenti nel neurone di proiezione, di per sé, contribuiscono al processo dis-inibitorio. Ad esempio, la lesione del nervo periferico regola profondamente il co-trasportatore K + -Cl- KCC2, che è essenziale per mantenere i normali gradienti K + e Cl- attraverso la membrana plasmatica (Coull et al., 2003). La downregolazione di KCC2, che è espressa nei neuroni di proiezione della lamina I, si traduce in uno spostamento nel gradiente Cl, tale che l'attivazione dei recettori GABA-A depolarizza, piuttosto che iperpolarizzare i neuroni di proiezione della lamina I. Ciò, a sua volta, aumenterebbe l'eccitabilità e aumenterebbe la trasmissione del dolore. Infatti, il blocco farmacologico o la sottoregolazione mediata da siRNA di KCC2 nel ratto induce allodinia meccanica. Tuttavia, Zeilhofer e colleghi suggeriscono che, anche dopo un infortunio, rimane un tono inibitorio sufficiente tale che il potenziamento della neurotrasmissione GABAergica spinale potrebbe essere un valido approccio per ridurre l'ipersensibilità al dolore indotta dalla lesione dei nervi periferici (Knabl et al., 2008). Infatti, studi sui topi suggeriscono che i farmaci specificamente mirati ai complessi GABAA contenenti subunità? 2 e / o? 3 riducono il dolore infiammatorio e neuropatico senza produrre effetti collaterali sedativi-ipnotici tipicamente associati alle benzodiazepine, che aumentano l'attività dei canali contenenti? 1.
La disinibizione può anche avvenire attraverso la modulazione della segnalazione glicinergica. In questo caso il meccanismo coinvolge l'azione del midollo spinale delle prostaglandine (Harvey et al., 2004). In particolare, la lesione tissutale induce il rilascio spinale della prostaglandina, PGE2, che agisce sui recettori EP2 espressi dagli interneuroni eccitatori e dai neuroni di proiezione nel corno dorsale superficiale. Stimolazione risultante della via cAMP-PKA fosforila le subunità del recettore della glicina GlyRa3, rendendo i neuroni che non rispondono agli effetti inibitori della glicina. Di conseguenza, i topi privi del gene GlyRa3 hanno una ridotta ipersensibilità termica e meccanica nei modelli di danno tissutale.
Interazioni gliale-neuronale
Infine, anche le cellule gliali, in particolare la microglia e gli astrociti, contribuiscono al processo di sensibilizzazione centrale che si verifica nel contesto della lesione. In condizioni normali, le microglia funzionano come macrofagi residenti nel sistema nervoso centrale. Sono distribuiti in modo omogeneo all'interno della materia grigia del midollo spinale e si presume che funzionino come sentinelle di lesioni o infezioni. Entro poche ore dalla lesione del nervo periferico, tuttavia, la microglia si accumula nel corno dorsale superficiale all'interno della zona di terminazione delle fibre nervose periferiche danneggiate. Le microglia circondano anche i corpi cellulari dei motoneuroni del corno ventrale, i cui assoni periferici sono contemporaneamente danneggiati. La microglia attivata rilascia una panoplia di molecole di segnalazione, comprese le citochine (come TNF- ?, interleuchina-1? E 6), che aumentano la sensibilizzazione centrale neuronale e il dolore persistente indotto da lesioni nervose (DeLeo et al., 2007). In effetti, l'iniezione di microglia cerebrale attivata nel liquido spinale cerebrale a livello del midollo spinale può riprodurre i cambiamenti comportamentali osservati dopo una lesione nervosa (Coull et al., 2005). Pertanto, sembra che l'attivazione della microglia sia sufficiente per innescare la condizione di dolore persistente (Tsuda et al., 2003).
Poiché le microglia vengono attivate a seguito di lesioni del tessuto nervoso, ma non del tessuto infiammatorio, ne consegue che l'attivazione della fibra afferente, che si verifica in entrambe le condizioni di lesione, non è il fattore critico per l'attivazione della microglia. Piuttosto, il danno fisico della periferica afferente deve indurre il rilascio di segnali specifici che vengono rilevati dalla microglia. Il principale tra questi è l'ATP, che si rivolge ai recettori purinergici di tipo microgliale P2. Di particolare interesse sono i sottotipi di recettori P2X4 (Tsuda et al., 2003), P2X7 (Chessell et al., 2005) e P2Y12 (Haynes et al., 2006; Kobayashi et al., 2008). Infatti, l'ATP è stato utilizzato per attivare la microglia del cervello negli studi sul trapianto di midollo spinale di cui sopra (Tsuda et al., 2003). Inoltre, il blocco genetico o farmacologico della funzione del recettore purinergico (Chessell et al., 2005; Tozaki-Saitoh et al., 2008; Ulmann et al., 2008) previene o inverte l'allodinia meccanica indotta da danno nervoso (Honore et al., 2006 ; Kobayashi et al., 2008; Tozaki-Saitoh et al., 2008; Tsuda et al., 2003).
Coull e colleghi hanno proposto un modello in cui l'attivazione della microglia mediata da ATP / P2X4 innesca un meccanismo di disinibizione (Coull et al., 2005). In particolare, hanno dimostrato che l'attivazione evocata dall'ATP dei recettori P2X4 induce il rilascio del fattore neurotrofico derivato dal cervello (BDNF) dalla microglia. Il BDNF, a sua volta, agisce sui recettori TrkB sui neuroni di proiezione della lamina I, per generare un cambiamento nel gradiente Cl, che come descritto sopra, sposterebbe l'azione del GABA dall'iperpolarizzazione alla depolarizzazione. Non è noto se l'effetto indotto da BDNF coinvolga l'espressione di KCC2, come accade dopo una lesione nervosa. Indipendentemente dal meccanismo, il risultato netto è che l'attivazione della microglia sensibilizzerà i neuroni della lamina I in modo tale che la loro risposta agli input monosinaptici dei nocicettori o agli input indiretti di A? afferenti, è migliorato.
Oltre al BDNF, le microglia attivate, come i macrofagi periferici, rilasciano e rispondono a numerose chemochine e citochine, e anche queste contribuiscono alla sensibilizzazione centrale. Ad esempio, nell'animale (normale) illeso, la chemochina fractalkine (CXCL1) è espressa sia da afferenti primari che da neuroni del midollo spinale (Lindia et al., 2005; Verge et al., 2004; Zhuang et al., 2007). Al contrario, il recettore di fractalkine (CX3CR1) è espresso su cellule microgliali e, soprattutto, è sovraregolato dopo lesione del nervo periferico (Lindia et al., 2005; Zhuang et al., 2007). Poiché la distribuzione spinale di fractalkine può attivare la microglia, sembra che il rilascio di fractalkine indotto da lesioni nervose fornisca ancora un'altra via attraverso la quale la microglia può essere impegnata nel processo di sensibilizzazione centrale. Infatti il blocco di CX3CR1 con un anticorpo neutralizzante previene sia lo sviluppo che il mantenimento del dolore persistente indotto da lesioni (Milligan et al., 2004; Zhuang et al., 2007). Questo percorso può anche essere parte di un ciclo di feedback positivo attraverso il quale le fibre nervose danneggiate e le cellule microgliali interagiscono in modo reciproco e ricorrente per amplificare i segnali del dolore. Questo punto è sottolineato dal fatto che la fractalkine deve essere scissa dalla superficie neuronale prima della segnalazione, un'azione che viene svolta dalla proteasi derivata dalla microglia, la catepsina S, inibitori dei quali riducono l'allodinia e l'iperalgesia indotte da danno nervoso (Clark et al., 2007). È importante sottolineare che la somministrazione spinale di catepsina S genera ipersensibilità comportamentale in wild type, ma non in topi knockout CX3CX1, che collega la catepsina S alla segnalazione di fractalkine (Clark et al., 2007; Zhuang et al., 2007). Anche se il fattore (i) che avvia il rilascio di catepsina S dalla microglia rimane da determinare ,. L'ATP sembra una possibilità ragionevole.
Molto recentemente, diversi membri della famiglia dei recettori Toll-like (TLR) sono stati implicati nell'attivazione della microglia in seguito a lesione del nervo. I TLR sono proteine di trasmissione transmembrana espresse in cellule immunitarie periferiche e glia. Come parte del sistema immunitario innato, riconoscono le molecole che sono ampiamente condivise dai patogeni. L'inibizione genetica o farmacologica della funzione TLR2, TLR3 o TLR4 nei topi non solo determina una diminuita attivazione microgliale, ma riduce anche l'ipersensibilità innescata dalla lesione del nervo periferico (Kim et al., 2007; Obata et al., 2008; Tanga et al. , 2005). Sconosciuti sono i ligandi endogeni che attivano TLR2-4 dopo lesione del nervo. Tra i candidati ci sono mRNA o proteine da shock termico che potrebbero fuoriuscire dai neuroni afferenti primari danneggiati e diffondere nel milieu extracellulare del midollo spinale.
Il contributo degli astrociti alla sensibilizzazione centrale è meno chiaro. Gli astrociti sono indiscutibilmente indotti nel midollo spinale dopo una lesione al tessuto o al nervo (per una revisione, vedi Ren e Dubner, 2008). Ma, a differenza delle microglia, l'attivazione degli astrociti viene generalmente ritardata e persiste molto più a lungo, fino a diversi mesi. Una possibilità interessante è che gli astrociti sono più critici per il mantenimento, piuttosto che l'induzione della sensibilizzazione centrale e del dolore persistente.
Infine, vale la pena notare che la lesione periferica non attiva solo la glia nel midollo spinale, ma anche nel tronco cerebrale, dove le glia contribuiscono alle influenze facilitatorie sopraspinali sull'elaborazione dei messaggi di dolore nel midollo spinale (vedi Figura 2), un fenomeno chiamato facilitazione decrescente (per una recensione, vedi Ren e Dubner, 2008). Tale facilitazione è particolarmente importante nell'impostazione della lesione e sembra neutralizzare i controlli inibitori a feedback che derivano contemporaneamente da vari loci del tronco cerebrale (Porreca et al., 2002).

Insight di Dr. Alex Jimenez
Come stabilito dall'Associazione internazionale per lo studio del dolore, o IASP, il dolore è "una spiacevole esperienza sensoriale ed emotiva associata a danno del tessuto acutale o potenziale, o descritta in termini di danno tissutale o di entrambi. Numerosi studi di ricerca sono stati proposti per dimostrare le basi fisiologiche del dolore, tuttavia, nessuno è stato in grado di includere tutti gli aspetti associati alla percezione del dolore. Comprendere i meccanismi del dolore del dolore acuto rispetto al dolore cronico è fondamentale durante le valutazioni cliniche poiché ciò può aiutare a determinare il miglior approccio terapeutico per i pazienti con problemi di salute di base.
Specificità nei messaggi di trasmissione e controllo del dolore
Comprendere come gli stimoli sono codificati dal sistema nervoso per suscitare comportamenti appropriati è di fondamentale importanza per lo studio di tutti i sistemi sensoriali. Nella forma più semplice, un sistema sensoriale utilizza linee etichettate per trasdurre gli stimoli e suscitare comportamenti attraverso circuiti strettamente segregati. Questo è forse meglio esemplificato dal sistema del gusto, in cui lo scambio di un recettore dolce per uno amaro in una popolazione di "dolce sapore afferente" non altera il comportamento provocato dall'attività in quella linea etichettata; in queste condizioni, un gusto amaro stimola questi afferenti a suscitare una percezione di dolcezza (Mueller et al., 2005).
Nel percorso del dolore, ci sono anche prove a supporto dell'esistenza di linee etichettate. Come accennato in precedenza, il calore e il freddo sono rilevati da sottoinsiemi in gran parte distinti di fibre afferenti primarie. Inoltre, l'eliminazione di sottoinsiemi di nocicettori può produrre deficit selettivi nella risposta comportamentale a una particolare modalità nociva. Ad esempio, la distruzione dei nocicettori che esprimono TRPV1 produce una profonda perdita di dolore da calore (compresa l'iperalgesia da calore), senza variazioni della sensibilità a stimoli meccanici o freddi dolorosi. Al contrario, la delezione del sottoinsieme MrgprD dei nocicettori si traduce in un deficit altamente selettivo nella reattività meccanica, senza cambiamenti nella sensibilità al calore (Cavanaugh et al., 2009). Ulteriori prove di segregazione funzionale a livello del nocicettore provengono dall'analisi di due diversi sottotipi di recettori oppioidi (Scherrer et al., 2009). In particolare, il recettore mu oppioide (MOR) predomina nella popolazione peptidergica, mentre il delta oppioide recettore (DOR) è espresso in nocicettori non peptidergici. Gli agonisti MOR-selettivi bloccano il dolore termico, mentre gli agonisti selettivi della DOR bloccano il dolore meccanico, dimostrando ancora una volta la separazione funzionale delle popolazioni nocicettive molecolarmente distinte.
Queste osservazioni sostengono la specificità comportamentale rilevante a livello del nocicettore. Tuttavia, questa è probabilmente una semplificazione eccessiva per almeno due motivi. Innanzitutto, molti nocicettori sono polimodali e possono quindi essere attivati da stimoli termici, meccanici o chimici, lasciando a chiedersi come l'eliminazione di grandi coorti di nocicettori possa avere effetti specifici della modalità. Ciò sostiene un contributo sostanziale dei circuiti spinali al processo mediante il quale i segnali nocicettivi sono codificati in distinte modalità del dolore. Infatti, un importante obiettivo futuro è quello di delineare meglio i sottotipi neuronali all'interno del corno dorsale e caratterizzare le loro interazioni sinaptiche con sottopopolazioni funzionalmente o molecolarmente definite di nocicettori. In secondo luogo, il sistema del dolore mostra un'enorme capacità di cambiamento, in particolare nel contesto di un infortunio, sollevando domande su se e come un sistema di linee etichettate possa ospitare tale plasticità e su come le alterazioni di tali meccanismi siano alla base di cambiamenti disadattivi che producono dolore cronico. Infatti, sappiamo che la soppressione mediata da P-saporina di una discreta popolazione di neuroni del corno dorsale della lamina I, che esprimono il recettore P della sostanza, può ridurre sia l'ipersensibilità al dolore termico e meccanico che si verifica dopo un danno tissutale o nervoso (Nichols et al. ., 1999). Tali osservazioni suggeriscono che nell'impostazione della specificità del pregiudizio la linea etichettata non viene mantenuta rigorosamente in quanto le informazioni vengono trasmesse ai livelli più alti del neurossis.
Chiaramente, le risposte a queste domande richiederanno l'uso combinato di metodi anatomici, elettrofisiologici e comportamentali per mappare i circuiti fisici e funzionali che sono alla base della nocicezione e del dolore. L'identificazione in corso di molecole e geni che contrassegnano specifici tipi di cellule neuronali (sia periferiche che centrali) fornisce strumenti essenziali con cui manipolare geneticamente o farmacologicamente questi neuroni e collegare le loro attività a componenti specifici del comportamento del dolore in circostanze normali e patofisiologiche. Ciò dovrebbe portarci più vicino alla comprensione di come il dolore acuto lasci il posto ai cambiamenti disadattivi che producono dolore cronico e come questo interruttore possa essere prevenuto o invertito.

Canapa contro Marijuana: qual è la differenza?
Con circa la metà degli Stati americani che ora autorizzano la vendita di marijuana medica, e alcuni addirittura consentendo la vendita di marijuana per uso ricreativo, sempre più persone si interessano ai possibili benefici per la salute di questa pianta controversa.
Mentre la scienza sul suo uso medico continua ad avanzare, molte persone in questi giorni stanno valutando come potrebbero accedere ai benefici per la salute della pianta senza sperimentare il suo noto effetto psicoattivo indesiderato. Questo è completamente possibile con il parente stretto della marijuana, la canapa ma è essenziale che tu sia consapevole della differenza in modo che tu possa essere un consumatore intelligente.
Una Cultivar della stessa pianta
Fondamentalmente, sia la canapa che la marijuana sono esattamente la stessa pianta: Cannabis sativa. Ci sono prove che la Cannabis sativa L sia stata coltivata in Asia migliaia di anni fa per la sua fibra e per l'approvvigionamento di cibo. Gli umani alla fine si resero conto che le cime fiorite della pianta avevano proprietà psicoattive. Con il tempo, come hanno fatto gli umani con molte altre piante, i coltivatori di cannabis hanno iniziato a coltivare piante specifiche per migliorare proprietà specifiche.
Oggigiorno, anche se alcuni potrebbero sostenere il vero numero di tipi di piante, ci sono davvero due semplici distinzioni,
Canapa - Una pianta coltivata principalmente al di fuori degli Stati Uniti, sebbene alcuni paesi statunitensi la facciano coltivare per scopi di studio) per l'uso in vestiti, carta, biocarburanti, bioplastiche, integratori alimentari, cosmetici e alimenti. La canapa è coltivata all'aperto come una grande coltura con piante sia maschili che femminili per aumentare l'impollinazione e migliorare la produzione di semi. La canapa industriale importata legalmente contiene meno del 0.3 percento del suo tetraidrocannabinolo chimico cancerogeno, o THC, contenuto. In realtà, la canapa importata legalmente di solito elimina in modo specifico tutti gli estratti nelle cime fiorite della pianta.
Marijuana (Marihuana) - Cannabis sativa coltivata appositamente per migliorare il suo contenuto di THC da utilizzare a scopo medicinale o ricreativo. Le piante di marijuana sono tipicamente coltivate al chiuso, in condizioni controllate, ei coltivatori eliminano tutte le piante maschili dalla raccolta per prevenire la fecondazione perché la fecondazione abbassa il grado di THC della pianta.
Legalità della marijuana medica
L'uso medico della marijuana è un'aumentata area di controversie per ricercatori e consumatori. Sebbene forse non metà degli Stati Uniti abbia legalizzato l'uso medico di questa pianta, rimane illegale secondo la legge federale, e di conseguenza il suo uso rimane controverso indipendentemente dal fatto che sembrino esserci reali benefici per la salute per vari gravi problemi di salute.
Coloro che stanno cercando di usare la marijuana per uso medico dovrebbero parlare dei suoi benefici rispetto ai suoi pericoli con un professionista sanitario qualificato prima di usarlo. Inoltre, molti consumatori che sono interessati ai suoi benefici per la salute non hanno bisogno degli effetti collaterali psicoattivi di THC o del pericolo di un test farmacologico positivo.
Canapa: benefici per la salute senza i rischi
La canapa importata, che ha un livello di THC molto basso, quasi assente, può essere una soluzione per i consumatori che cercano benefici per la salute della pianta meno gli effetti del THC.
Sebbene il THC abbia alcuni benefici per la salute, la canapa comprende più di composti bioattivi 80 che potrebbero fornire un supporto eccellente per una serie di problemi di salute, come risposta allo stress, umore positivo, disagio fisico o dolore. La canapa può anche portare benefici alla salute gastrointestinale, contribuire a mantenere una risposta infiammatoria sana in tutto il corpo e supportare la normale funzione immunitaria.
Se stai considerando l'uso di un prodotto integratore alimentare che include la canapa, allora è l'ideale per acquistare un prodotto da una fonte attendibile.
In conclusione, sia il sistema nervoso periferico che quello centrale rilevano, interpretano e regolano un'ampia gamma di stimoli termici e meccanici, nonché irritanti chimici ambientali ed endogeni. Se gli stimoli sono troppo intensi, può generare dolore acuto dove, nel caso di dolore persistente o cronico, la trasmissione del dolore può essere tremendamente influenzata. L'articolo sopra descrive i meccanismi cellulari e molecolari del dolore come guida nelle valutazioni cliniche. Inoltre, l'uso della canapa può avere molti benefici per la salute rispetto agli effetti controversi della marijuana. Informazioni referenziate dal National Center for Biotechnology Information (NCBI). Lo scopo delle nostre informazioni è limitato alla chiropratica e alle lesioni e condizioni della colonna vertebrale. Per discutere l'argomento, non esitate a chiedere al Dr. Jimenez o contattarci a 915-850-0900 .
A cura di Dr. Alex Jimenez
Abrahamsen B, Zhao J, Asante CO, Cendan CM, Marsh S, Martinez-Barbera JP, Nassar MA, Dickenson AH, Wood JN. La base cellulare e molecolare del dolore meccanico, freddo e infiammatorio. Scienza. 2008; 321: 702-705. [PubMed]
Akopian AN, Souslova V, Inghilterra S, Okuse K, Ogata N, Ure J, Smith A, Kerr BJ, McMahon SB, Boyce S, et al. Il canale del sodio resistente alla tetrodotossina SNS ha una funzione specializzata nei percorsi del dolore. Nat Neurosci. 1999; 2: 541-548. [PubMed]
Alessandri-Haber N, Dina OA, Joseph EK, Reichling D, Levine JD. Un meccanismo transitorio di vanilloide 4 dipendente dipendente da iperalgesia è coinvolto dall'azione concertata dei mediatori dell'infiammazione. J Neurosci. 2006; 26: 3864-3874. [PubMed]
Andersson DA, Gentry C, Moss S, Bevan S. Potenziale recettoriale transitorio A1 è un recettore sensoriale per molteplici prodotti di stress ossidativo. J Neurosci. 2008; 28: 2485-2494. [Articolo gratuito di PMC] [PubMed]
Apkarian AV, Bushnell MC, Treede RD, Zubieta JK. Meccanismi del cervello umano della percezione e regolazione del dolore in salute e malattia. Eur J Pain. 2005; 9: 463-484. [PubMed]
Attal N, Bouhassira D, Gautron M, Vaillant JN, Mitry E, Lepere C, Rougier P, Guirimand F. Iperalgesia termica come marker della neurotossicità di oxaliplatino: uno studio prospettico di valutazione sensoriale quantificato. Dolore. 2009; 144: 245-252. [PubMed]
Atzeni F, Turiel M, Capsoni F, Doria A, Meroni P, Sarzi-Puttini P. Autoimmunità e agenti anti-TNF-alfa. Ann NY Acad Sci. 2005; 1051: 559-569. [PubMed]
Bandell M, Storia GM, Hwang SW, Viswanath V, Eid SR, Petrus MJ, Earley TJ, Patapoutian A. Il canale di ioni freddo Noxious TRPA1 è attivato da composti pungenti e bradykinin. Neurone. 2004; 41: 849-857. [PubMed]
Basbaum AI, Jessell T. The Perception of Pain. In: Kandel ER, Schwartz J, Jessell T, editori. Principi di neuroscienza. New York: Appleton e Lange; 2000. pp. 472-491.
Bautista DM, Jordt SE, Nikai T, Tsuruda PR, Read AJ, Poblete J, Yamoah EN, Basbaum AI, Julius D. TRPA1 mediano le azioni infiammatorie degli agenti irritanti ambientali e proalgesici. Cellula. 2006; 124: 1269-1282. [PubMed]
Bautista DM, Siemens J, Glazer JM, Tsuruda PR, Basbaum AI, Stucky CL, Jordt SE, Julius D. Il recettore del mentolo TRPM8 è il principale rilevatore di freddo ambientale. Natura. 2007; 448: 204-208. [PubMed]
Bautista DM, Sigal YM, Milstein AD, Garrison JL, Zorn JA, Tsuruda PR, Nicoll RA, Julius D. Gli agenti pungenti dei peperoni di Sichuan eccitano i neuroni sensoriali inibendo i canali del potassio a due pori. Nat Neurosci. 2008; 11: 772-779. [Articolo gratuito di PMC] [PubMed]
Bessac BF, Jordt SE. Canali TRP mozzafiato: TRPA1 e TRPV1 per la chemiosensazione delle vie aeree e il controllo del riflesso. Fisiologia (Bethesda) 2008; 23: 360-370. [Articolo gratuito di PMC] [PubMed]
Bhattacharya MR, Bautista DM, Wu K, Haeberle H, Lumpkin EA, Julius D. L'allungamento radiale rivela popolazioni distinte di neuroni somatosensoriali di mammifero meccanosensibili. Proc Natl Acad Sci US A. 2008; 105: 20015-20020. [Articolo gratuito di PMC] [PubMed]
Brown DA, Passmore GM. Canali Neural KCNQ (Kv7). Br J Pharmacol. 2009; 156: 1185-1195. [Articolo gratuito di PMC] [PubMed]
Bryant BP, Mezine I. Alchilammidi che producono parestesia formicolio attivano i neuroni trigeminali tattili e termici. Cervello. 1999; 842: 452-460. [PubMed]
Caceres AI, Brackmann M, Elia MD, Bessac BF, del Camino D, D'Amours M, Witek JS, Fanger CM, Chong JA, Hayward NJ, et al. Un canale ionico sensoriale sensoriale essenziale per l'infiammazione delle vie aeree e iperreattività nell'asma. Proc Natl Acad Sci US A. 2009; 106: 9099-9104. [Articolo gratuito di PMC] [PubMed]
Campbell JN, Raja SN, Meyer RA, Mackinnon SE. Le afferenze mielinizzate segnalano l'iperalgesia associata alla lesione del nervo. Dolore. 1988; 32: 89-94. [PubMed]
Cao YQ. Canali e dolore del calcio voltaggio-dipendenti. Dolore. 2006; 126: 5-9. [PubMed]
Caterina MJ, Leffler A, Malmberg AB, Martin WJ, Trafton J, Petersen-Zeitz KR, Koltzenburg M, Basbaum AI, Julius D. Notoriazione nocicettiva e sensazione di dolore nei topi privi del recettore della capsaicina. Scienza. 2000; 288: 306-313. [PubMed]
Caterina MJ, Rosen TA, Tominaga M, freno AJ, Julius D. Un omologo di capsaicina con una soglia alta per il caldo nocivo. Natura. 1999; 398: 436-441. [PubMed]
Caterina MJ, Schumacher MA, Tominaga M, Rosen TA, Levine JD, Julius D. Il recettore della capsaicina: un canale ionico attivato dal calore nella via del dolore. Natura. 1997; 389: 816-824. [PubMed]
Cavanaugh DJ, Lee H, Lo L, Shields SD, Zylka MJ, Basbaum AI, Anderson DJ. Sottogruppi distinti di fibre sensoriali primarie non mielinizzate mediano le risposte comportamentali a stimoli termici e meccanici nocivi. Proc Natl Acad Sci US A. 2009; 106: 9075-9080. [Articolo gratuito di PMC] [PubMed]
Cesare P, McNaughton P. Una nuova corrente attivata dal calore nei neuroni nocicettivi e la sua sensibilizzazione da parte della bradichinina. Proc Natl Acad Sci US A. 1996; 93: 15435-15439. [Articolo gratuito di PMC] [PubMed]
Chalfie M. Meccanotrasduzione neurosensoriale. Nat Rev Mol Cell Biol. 2009; 10: 44-52. [PubMed]
Chao MV. Neurotropine e i loro recettori: un punto di convergenza per molte vie di segnalazione. Nat Rev Neurosci. 2003; 4: 299-309. [PubMed]
Chen L, Huang LY. La protein-chinasi C riduce il blocco Mg2 + dei canali del recettore NMDA come meccanismo di modulazione. Natura. 1992; 356: 521-523. [PubMed]
Chen X, Alessandri-Haber N, Levine JD. Attenuazione marcata della sensibilizzazione alle fibre C indotta dal mediatore infiammatorio per stimoli meccanici e ipotonici nei topi TRPV4 - / -. Mol Pain. 2007; 3: 31. [Articolo gratuito di PMC] [PubMed]
Chessell IP, Hatcher JP, Bountra C, Michel AD, Hughes JP, Green P, Egerton J, Murfin M, Richardson J, Peck WL, et al. La rottura del gene del purinocettore P2X7 abolisce il dolore infiammatorio e neuropatico cronico. Dolore. 2005; 114: 386-396. [PubMed]
Cho H, Koo JY, Kim S, Park SP, Yang Y, Oh U. Un nuovo canale meccanosensibile identificato nei neuroni sensoriali. Eur J Neurosci. 2006; 23: 2543-2550. [PubMed]
Cho H, Shin J, Shin CY, Lee SY, Oh U. Canali di ioni meccanosensibili in neuroni sensoriali in coltura di ratti neonatali. J Neurosci. 2002; 22: 1238-1247. [PubMed]
Chuang HH, Prescott ED, Kong H, Shields S, Jordt SE, Basbaum AI, Chao MV, Julius D. Bradykinin e fattore di crescita del nervo rilasciano il recettore della capsaicina da PtdIns (4,5) inibizione mediata da P2. Natura. 2001; 411: 957-962. [PubMed]
Chung MK, Lee H, Caterina MJ. Le temperature calde attivano TRPV4 nei cheratinociti 308 del mouse. J Biol Chem. 2003; 278: 32037-32046. [PubMed]
Clark AK, Yip PK, Grist J, Gentry C, Staniland AA, Marchand F, Dehvari M, Wotherspoon G, Winter J, Ullah J, et al. Inibizione della catepsina microgliale spinale S per l'inversione del dolore neuropatico. Proc Natl Acad Sci US A. 2007; 104: 10655-10660. [Articolo gratuito di PMC] [PubMed]
Colburn RW, Lubin ML, Stone DJ, Jr, Wang Y, Lawrence D, D'Andrea MR, Brandt MR, Liu Y, Flores CM, Qin N. Attenuata sensibilità al freddo in topi null TRPM8. Neurone. 2007; 54: 379-386. [PubMed]
Coull JA, Beggs S, Boudreau D, Boivin D, Tsuda M, Inoue K, Gravel C, Salter MW, De Koninck Y. BDNF provocano il passaggio del gradiente di anioni neuronali alla base del dolore neuropatico. Natura. 2005; 438: 1017-1021. [PubMed]
Coull JA, Boudreau D, Bachand K, Prescott SA, Nault F, Sik A, De Koninck P, De Koninck Y. Spostamento trans-sinaptico nel gradiente anionico nei neuroni della lamina spinale I come meccanismo del dolore neuropatico. Natura. 2003; 424: 938-942. [PubMed]
Cox JJ, Reimann F, Nicholas AK, Thornton G, Roberts E, Springell K, Karbani G, Jafri H, Mannan J, Raashid Y, et al. Una canalopatia di SCN9A causa l'incapacità congenita di provare dolore. Natura. 2006; 444: 894-898. [PubMed]
Cruz-Orengo L, Dhaka A, Heuermann RJ, Young TJ, Montana MC, Cavanaugh EJ, Kim D, Storia GM. Nocicezione cutanea evocata da 15-delta PGJ2 tramite attivazione del canale ionico TRPA1. Mol Pain. 2008; 4: 30. [Articolo gratuito di PMC] [PubMed]
Davies A, Hendrich J, Van Minh AT, Wratten J, Douglas L, Dolphin AC. Biologia funzionale delle subunità delta alfa (2) dei canali del calcio voltaggio-dipendenti. Tendenze Pharmacol Sci. 2007; 28: 220-228. [PubMed]
Davis JB, Gray J, Gunthorpe MJ, Hatcher JP, Davey PT, Overend P, Harries MH, Latcham J, Clapham C, Atkinson K, et al. Il recettore vanilloide-1 è essenziale per l'iperalgesia termica infiammatoria. Natura. 2000; 405: 183-187. [PubMed]
DeLeo JA, Sorkin LS, Watkins LR, editori. Regolazione immunitaria e gliale del dolore. IASP; Seattle: 2007.
de Vries B, Frants RR, Ferrari MD, van den Maagdenberg AM. Genetica molecolare dell'emicrania. Hum Genet. 2009; 126: 115-132. [PubMed]
Dhaka A, Murray AN, Mathur J, Earley TJ, Petrus MJ, Patapoutian A. TRPM8 è richiesto per la sensazione di freddo nei topi. Neurone. 2007; 54: 371-378. [PubMed]
Dib-Hajj SD, Yang Y, Waxman SG. Genetica e patofisiologia molecolare delle sindromi dolorose correlate a Na (v) 1.7. Adv Genet. 2008; 63: 85-110. [PubMed]
Dick IE, Brochu RM, Purohit Y, Kaczorowski GJ, Martin WJ, Priest BT. Il blocco del canale del sodio può contribuire all'efficacia analgesica degli antidepressivi. J Pain. 2007; 8: 315-324. [PubMed]
Dobler TM, Springauf A, Tovornik S, Weber M, Schmitt A, Sedlmeier R, Wischmeyer E, Doring F. I canali K + a due pori del dominio KES costituiscono una componente significativa delle correnti di potassio di fondo nei neuroni DRG murini. J Physiol 2007 [articolo gratuito di PMC] [PubMed]
Dong X, Han S, Zylka MJ, Simon MI, Anderson DJ. Una famiglia diversificata di GPCR espressi in sottoinsiemi specifici di neuroni sensoriali nocicettivi. Cellula. 2001; 106: 619-632. [PubMed]
Drdla R, Sandkuhler J. Potenziamento a lungo termine alle sinapsi della C-fibra mediante attività presinaptica di basso livello in vivo. Mol Pain. 2008; 4: 18. [Articolo gratuito di PMC] [PubMed]
Drew LJ, Rohrer DK, Price MP, Blaver KE, Cockayne DA, Cesare P, Wood JN. I canali ionici a rilevamento acido ASIC2 e ASIC3 non contribuiscono alle correnti attivate meccanicamente nei neuroni sensoriali dei mammiferi. J Physiol. 2004; 556: 691-710. [Articolo gratuito di PMC] [PubMed]
Drew LJ, Wood JN, Cesare P. Proprietà meccanosensibili distinte dei neuroni sensoriali sensibili alla capsaicina e sensibili. J Neurosci. 2002; 22: RC228. [PubMed]
Estacion M, Dib-Hajj SD, Benke PJ, Te Morsche RH, Eastman EM, Macala LJ, Drenth JP, Waxman SG. Mutazioni di guadagno di funzione NaV1.7 come continuum: A1632E mostra cambiamenti fisiologici associati a mutazioni dell'eritromelalgia e parossistiche di dolore estremo e produce sintomi di entrambi i disturbi. J Neurosci. 2008; 28: 11079-11088. [PubMed]
Fertleman CR, Baker MD, Parker KA, Moffatt S, Elmslie FV, Abrahamsen B, Ostman J, Klugbauer N, Wood JN, Gardiner RM, et al. Mutazioni di SCN9A nel disturbo parossistico da dolore estremo: le varianti alleliche sono alla base di difetti e fenotipi del canale distinti. Neurone. 2006; 52: 767-774. [PubMed]
Gevaert T, Vriens J, Segal A, Everaerts W, Roskams T, Talavera K, Owsianik G, Liedtke W, Daelemans D, Dewachter I, et al. La cancellazione del canale cationico potenziale transitorio del recettore TRPV4 danneggia lo svuotamento della vescica murina. J Clin Invest. 2007; 117: 3453-3462. [Articolo gratuito di PMC] [PubMed]
Grant AD, Cottrell GS, Amadesi S, Trevisani M, Nicoletti P, Materazzi S, Altier C, Cenac N, Zamponi GW, Bautista-Cruz F, et al. Il recettore attivato dalla proteasi 2 sensibilizza il canale di ioni vanilloide 4 del recettore transitorio potenziale a causare iperalgesia meccanica nei topi. J Physiol. 2007; 578: 715-733. [Articolo gratuito di PMC] [PubMed]
Guler AD, Lee H, Iida T, Shimizu I, Tominaga M, Caterina M. Attivazione evocata dal calore del canale ionico, TRPV4. J Neurosci. 2002; 22: 6408-6414. [PubMed]
Harvey RJ, Depner UB, Wassle H, Ahmadi S, Heindl C, Reinold H, Smart TG, Harvey K, Schutz B, Abo-Salem OM, et al. GlyR alpha3: un obiettivo essenziale per la sensibilizzazione al dolore infiammatorio mediato da PGE2. Scienza. 2004; 304: 884-887. [PubMed]
Haynes SE, Hollopeter G, Yang G, Kurpius D, Dailey ME, Gan WB, Julius D. Il recettore P2Y12 regola l'attivazione microgliale da nucleotidi extracellulari. Nat Neurosci. 2006; 9: 1512-1519. [PubMed]
Hensel H, Zotterman Y. L'effetto del mentolo sui termocettori. Acta Physiol Scand. 1951; 24: 27-34. [PubMed]
Hefti FF, Rosenthal A, Walicke PA, Wyatt S, Vergara G, Shelton DL, Davies AM. Nuova classe di farmaci antidolorifici basati sull'antagonismo di NGF. Tendenze Pharmacol Sci. 2006; 27: 85-91. [PubMed]
Hensel H, Zotterman Y. L'effetto del mentolo sui termocettori. Acta Physiol Scand. 1951; 24: 27-34. [PubMed]
Hill K, Schaefer M. TRPA1 è modulato in modo differenziale dalle molecole anfipatiche trinitrofenolo e clorpromazina. J Biol Chem. 2007; 282: 7145-7153. [PubMed]
Hinman A, Chuang HH, Bautista DM, Julius D. Attivazione del canale TRP mediante modifica covalente reversibile. Proc Natl Acad Sci US A. 2006; 103: 19564-19568. [Articolo gratuito di PMC] [PubMed]
Honore P, Chandran P, Hernandez G, Gauvin DM, Mikusa JP, Zhong C, Joshi SK, Ghilardi JR, Sevcik MA, Friggitrice RM, et al. Il dosaggio ripetuto di ABT-102, un antagonista potente e selettivo TRPV1, migliora l'attività analgesica mediata da TRPV1 nei roditori, ma attenua l'ipertermia indotta dall'antagonista. Dolore. 2009; 142: 27-35. [PubMed]
Honore P, Donnelly-Roberts D, Namovic MT, Hsieh G, Zhu CZ, Mikusa JP, Hernandez G, Zhong C, Gauvin DM, Chandran P, et al. A-740003 [N- (1 - {[(cianoimino) (5-chinolinilammino) metil] ammino} -2,2-dimetilpropil) -2- (3,4-dimetossifenil) acetammide], un antagonista del recettore P2X7 innovativo e selettivo, dose-dipendente riduce il dolore neuropatico nel ratto. J Pharmacol Exp Ther. 2006; 319: 1376-1385. [PubMed]
Hu J, Lewin GR. Correnti meccanosensibili nei neuriti dei neuroni sensoriali del topo in coltura. J Physiol. 2006; 577: 815-828. [Articolo gratuito di PMC] [PubMed]
Immke DC, McCleskey EW. Il lattato migliora il canale Na + sensibile all'acido sui neuroni che avvertono l'ischemia. Nat Neurosci. 2001; 4: 869-870. [PubMed]
Immke DC, McCleskey EW. I protoni aprono i canali ionici acido-sensoriali catalizzando il sollievo del blocco Ca2 +. Neurone. 2003; 37: 75-84. [PubMed]
Ji RR, Samad TA, Jin SX, Schmoll R, Woolf CJ. L'attivazione di p38 MAPK da parte di NGF nei neuroni sensoriali primari dopo l'infiammazione aumenta i livelli di TRPV1 e mantiene l'iperalgesia da calore. Neurone. 2002; 36: 57-68. [PubMed]
Jordt SE, Bautista DM, Chuang HH, McKemy DD, Zygmunt PM, Hogestatt ED, Meng ID, Julius D. Oli di senape e cannabinoidi eccitano le fibre nervose sensoriali attraverso il canale TRP ANKTM1. Natura. 2004; 427: 260-265. Epub 2004 Jan 2007. [PubMed]
Julius D, Basbaum AI. Meccanismi molecolari della nocicezione. Natura. 2001; 413: 203-210. [PubMed]
Karashima Y, Damann N, Prenen J, Talavera K, Segal A, Voets T, Nilius B. Azione bimodale del mentolo sul canale del potenziale transitorio TRPA1. J Neurosci. 2007; 27: 9874-9884. [PubMed]
Karashima Y, Talavera K, Everaerts W, Janssens A, Kwan KY, Vennekens R, Nilius B, Voets T. TRPA1 agisce come un sensore freddo in vitro e in vivo. Proc Natl Acad Sci US A. 2009; 106: 1273-1278. [Articolo gratuito di PMC] [PubMed]
Kawasaki Y, Kohno T, Zhuang ZY, Brenner GJ, Wang H, Van Der Meer C, Befort K, Woolf CJ, Ji RR. Recettori ionotropici e metabotropici, proteina chinasi A, proteina chinasi C e Src contribuiscono all'attivazione di ERK indotta dalla fibra C e alla fosforilazione della proteina legante l'elemento di risposta del cAMP nei neuroni del corno dorsale, portando a sensibilizzazione centrale. J Neurosci. 2004; 24: 8310-8321. [PubMed]
Keller AF, Beggs S, Salter MW, De Koninck Y. Trasformazione dell'output dei neuroni della lamina spinale dopo danno ai nervi e stimolazione della microglia alla base del dolore neuropatico. Mol Pain. 2007; 3: 27. [Articolo gratuito di PMC] [PubMed]
Kim D, Kim MA, Cho IH, Kim MS, Lee S, Jo EK, Choi SY, Park K, Kim JS, Akira S, et al. Un ruolo fondamentale del recettore 2 a pedaggio nell'attivazione delle cellule gliali delle ghiandole del midollo spinale e l'ipersensibilità al dolore. J Biol Chem. 2007; 282: 14975-14983. [PubMed]
Kindt KS, Viswanath V, Macpherson L, Quast K, Hu H, Patapoutian A, Schafer WR. Caenorhabditis elegans TRPA-1 funziona in meccanosensation. Nat Neurosci. 2007; 10: 568-577. [PubMed]
Kirschstein T, Busselberg D, Treede RD. Coespressione di correnti interne evocate dal calore e capsaicina-evocate in neuroni gangliari di radice dorsale di ratto acutamente dissociati. Neurosci Lett. 1997; 231: 33-36. [PubMed]
Knabl J, Witschi R, Hosl K, Reinold H, Zeilhofer UB, Ahmadi S, Brockhaus J, Sergejeva M, Hess A, Brune K, et al. Inversione del dolore patologico attraverso specifici sottotipi di recettori GABAA spinali. Natura. 2008; 451: 330-334. [PubMed]
Kobayashi K, Yamanaka H, Fukuoka T, Dai Y, Obata K, Noguchi K. L'upregolazione del recettore P2Y12 nella microglia attivata è un gateway del segnale p38 e del dolore neuropatico. J Neurosci. 2008; 28: 2892-2902. [PubMed]
Kwan KY, Allchorne AJ, Vollrath MA, Christensen AP, Zhang DS, Woolf CJ, Corey DP. TRPA1 contribuisce alla nocicezione fredda, meccanica e chimica ma non è essenziale per la trasduzione delle cellule ciliate. Neurone. 2006; 50: 277-289. [PubMed]
Kwan KY, Glazer JM, Corey DP, Rice FL, Stucky CL. TRPA1 modula la meccanotrasduzione nei neuroni sensoriali cutanei. J Neurosci. 2009; 29: 4808-4819. [Articolo gratuito di PMC] [PubMed]
Latremoliere A, Woolf CJ. Sensibilizzazione centrale: un generatore di ipersensibilità al dolore da parte della plasticità neurale centrale. J Pain. 2009; 10: 895-926. [Articolo gratuito di PMC] [PubMed]
Lawson JJ, McIlwrath SL, Woodbury CJ, Davis BM, Koerber HR. TRPV1 a differenza di TRPV2 è limitato a un sottogruppo di nocicettori cutanei meccanicamente insensibili che rispondono al calore. J Pain. 2008; 9: 298-308. [Articolo gratuito di PMC] [PubMed]
Leffler A, Linte RM, Nau C, Reeh P, Babes A. Un canale ad attivazione termica ad alta soglia in neuroni gangliari di ratti dorsali di ratti coltivati assomiglia a TRPV2 ed è bloccato dal gadolinio. Eur J Neurosci. 2007; 26: 12-22. [PubMed]
Liedtke W, Choe Y, Marti-Renom MA, Bell AM, Denis CS, Sali A, Hudspeth AJ, Friedman JM, Heller S. Canale osmoticamente correlato al recettore del vanilloide (VR-OAC), un osmorecettore vertebrato candidato. Cellula. 2000; 103: 525-535. [Articolo gratuito di PMC] [PubMed]
Liedtke W, Friedman JM. Regolazione osmotica anomala nei topi trpv4 - / -. Proc Natl Acad Sci US A. 2003; 100: 13698-13703. [Articolo gratuito di PMC] [PubMed]
Lin YW, Cheng CM, Leduc PR, Chen CC. Comprensione della meccanotrasduzione dei nervi sensoriali mediante controllo a matrice elastomerica localizzata. PLoS One. 2009; 4: e4293. [Articolo gratuito di PMC] [PubMed]
Lindia JA, McGowan E, Jochnowitz N, Abbadie C. Induzione dell'espressione di CX3CL1 in astrociti e CX3CR1 in microglia nel midollo spinale di un modello di dolore neuropatico al ratto. J Pain. 2005; 6: 434-438. [PubMed]
Liu XJ, Gingrich JR, Vargas-Caballero M, Dong YN, Sengar A, Beggs S, Wang SH, Ding HK, Frankland PW, Salter MW. Trattamento del dolore infiammatorio e neuropatico disaccoppiando Src dal complesso recettore NMDA. Nat Med. 2008; 14: 1325-1332. [Articolo gratuito di PMC] [PubMed]
Lumpkin EA, Caterina MJ. Meccanismi di trasduzione sensoriale nella pelle. Natura. 2007; 445: 858-865. [PubMed]
Luo ZD, Chaplan SR, Higuera ES, Sorkin LS, Stauderman KA, Williams ME, Yaksh TL. Sovraregolazione della subunità del canale del calcio 2 (delta) del ganglio della radice dorsale (alfa) e della sua correlazione con l'allodinia nei ratti danneggiati dai nervi spinali. J Neurosci. 2001; 21: 1868-1875. [PubMed]
Macpherson LJ, Dubin AE, Evans MJ, Marr F, Schultz PG, Cravatt BF, Patapoutian A. Composti nocivi attivano i canali ionici TRPA1 attraverso la modificazione covalente delle cisteine. Natura. 2007; 445: 541-545. [PubMed]
Madrid R, de la Pena E, Donovan-Rodriguez T, Belmonte C, Viana F. La soglia variabile dei neuroni trigemino-termosensibili al freddo è determinata da un equilibrio tra i canali del potassio TRPM8 e Kv1. J Neurosci. 2009; 29: 3120-3131. [PubMed]
Malan TP, Mata HP, Porreca F. Spinal GABA (A) e GABA (B) farmacologia del recettore in un modello di dolore neuropatico al ratto. Anestesiologia. 2002; 96: 1161-1167. [PubMed]
Malmberg AB, Chen C, Tonegawa S, Basbaum AI. Dolore acuto conservato e dolore neuropatico ridotto nei topi privi di PKCgamma. Scienza. 1997; 278: 279-283. [PubMed]
Mandadi S, Sokabe T, Shibasaki K, Katanosaka K, Mizuno A, Moqrich A, Patapoutian A, Fukumi-Tominaga T, Mizumura K, Tominaga M. TRPV3 nei cheratinociti trasmettono informazioni sulla temperatura ai neuroni sensoriali 2009 [articolo libero da PMC] [PubMed]
Materazzi S, Nassini R, Andre E, Campi B, Amadesi S, Trevisani M, Bunnett NW, Patacchini R, Geppetti P. I metaboliti degli acidi grassi Cox-dipendenti causano dolore attraverso l'attivazione del recettore irritante TRPA1. Proc Natl Acad Sci US A. 2008; 105: 12045-12050. [Articolo gratuito di PMC] [PubMed]
Matta JA, Cornett PM, Miyares RL, Abe K, Sahibzada N, Ahern GP. Gli anestetici generali attivano un canale ionico nocicettivo per migliorare il dolore e l'infiammazione. Proc Natl Acad Sci US A. 2008; 105: 8784-8789. [Articolo gratuito di PMC] [PubMed]
McKemy DD, Neuhausser WM, Julius D. L'identificazione di un recettore freddo rivela un ruolo generale per i canali TRP in termosensazione. Natura. 2002; 416: 52-58. [PubMed]
McMahon SB, Bennett DLH, Bevan S. Mediatori infiammatori e modulatori del dolore. In: McMahon SB, Koltzenburg M, editori. Manuale di Pain and Wall and Melzack. Elsevier; 2008. pp. 49-72.
Melzack R, Wall PD. Meccanismi del dolore: una nuova teoria. Scienza. 1965; 150: 971-979. [PubMed]
Messinger RB, Naik AK, Jagodic MM, Nelson MT, Lee WY, Choe WJ, Orestes P, Latham JR, Todorovic SM, Jevtovic-Todorovic V. Silenziamento in vivo dei canali di calcio Ca (V) 3.2 T in neuroni sensoriali allevia iperalgesia nei ratti con neuropatia diabetica indotta da streptozocina. Dolore. 2009; 145: 184-195. [Articolo gratuito di PMC] [PubMed]
Milligan ED, Sloane EM, Watkins LR. Glia in dolore patologico: un ruolo per fractalkine. J Neuroimmunol. 2008; 198: 113-120. [Articolo gratuito di PMC] [PubMed]
Milligan ED, Zapata V, Chacur M, Schoeniger D, Biedenkapp J, O'Connor KA, Verge GM, Chapman G, Green P, Foster AC, et al. La prova che la fractalchina esogena ed endogena può indurre una facilitazione spinale nocicettiva nei ratti. Eur J Neurosci. 2004; 20: 2294-2302. [PubMed]
Miraucourt LS, Dallel R, Voisin DL. La disfunzione inibitoria della glicina trasforma il tatto in dolore attraverso gli interneuroni della PKCgamma. PLoS One. 2007; 2: e1116. [Articolo gratuito di PMC] [PubMed]
Mochizuki T, Sokabe T, Araki I, Fujishita K, Shibasaki K, Uchida K, Naruse K, Koizumi S, Takeda M, Tominaga M. Il canale cationico TRPV4 media il rilascio di Ca2 + evocato dall'allungamento e il rilascio di ATP nelle colture di cellule uroteliali primarie. J Biol Chem. 2009; 284: 21257-21264. [Articolo gratuito di PMC] [PubMed]
Moore KA, Kohno T, Karchewski LA, Scholz J, Baba H, Woolf CJ. La lesione parziale del nervo periferico promuove una perdita selettiva dell'inibizione GABAergica nel corno dorsale superficiale del midollo spinale. J Neurosci. 2002; 22: 6724-6731. [PubMed]
Mueller KL, Hoon MA, Erlenbach I, Chandrashekar J, Zuker CS, Ryba NJ. I recettori e la logica di codifica per il gusto amaro. Natura. 2005; 434: 225-229. [PubMed]
Muraki K, Iwata Y, Katanosaka Y, Ito T, Ohya S, Shigekawa M, Imaizumi Y. TRPV2 è un componente dei canali cationici osmoticamente sensibili nei miociti aortici murini. Circ Ris. 2003; 93: 829-838. [PubMed]
Nagata K, Duggan A, Kumar G, Garcia-Anoveros J. Nociceptor e proprietà trasduttori di cellule pilifere di TRPA1, un canale per il dolore e l'udito. J Neurosci. 2005; 25: 4052-4061. [PubMed]
Nagy I, Rang H. Il calore nocivo attiva tutta la capsaicina-sensibile e anche una sotto-popolazione di neuroni gangliari della radice dorsale insensibili alla capsaicina. Neuroscienza. 1999; 88: 995-997. [PubMed]
Nassar MA, Levato A, Stirling LC, Wood JN. Il dolore neuropatico si sviluppa normalmente nei topi privi sia di Na (v) 1.7 che di Na (v) 1.8. Mol Pain. 2005; 1: 24. [Articolo gratuito di PMC] [PubMed]
Nassar MA, Stirling LC, Forlani G, Baker MD, Matthews EA, Dickenson AH, Wood JN. La delezione del gene specifico del nocicettore rivela un ruolo importante per Nav1.7 (PN1) nel dolore acuto e infiammatorio. Proc Natl Acad Sci US A. 2004; 101: 12706-12711. [Articolo gratuito di PMC] [PubMed]
Neumann S, Braz JM, Skinner K, Llewellyn-Smith IJ, Basbaum AI. L'input innocuo, non nocivo, attiva gli interneuroni della PKCgamma del corno dorsale spinale tramite fibre afferenti mielinizzate. J Neurosci. 2008; 28: 7936-7944. [Articolo gratuito di PMC] [PubMed]
Nichols ML, Allen BJ, Rogers SD, Ghilardi JR, Honore P, Luger NM, Finke MP, Li J, Lappi DA, Simone DA, et al. Trasmissione della nocicezione cronica da parte dei neuroni spinali che esprimono il recettore della sostanza P. Scienza. 1999; 286: 1558-1561. [PubMed]
Noel J, Zimmermann K, Busserolles J, Deval E, Alloui A, Diochot S, Guy N, Borsotto M, Reeh P, Eschalier A, et al. I canali K + attivati mechano TRAAK e TREK-1 controllano la percezione sia calda che fredda. EMBO J. 2009; 28: 1308-1318. [Articolo gratuito di PMC] [PubMed]
Obata K, Katsura H, Miyoshi K, Kondo T, Yamanaka H, Kobayashi K, Dai Y, Fukuoka T, Akira S, Noguchi K. Il recettore Toll-like 3 contribuisce all'attivazione gliale spinale e allodinia tattile dopo lesione del nervo. J Neurochem 2008 [PubMed]
Olausson H, Cole J, Rylander K, McGlone F, Lamarre Y, Wallin BG, Kramer H, Wessberg J, Elam M, Bushnell MC, et al. Ruolo funzionale delle afferenze tattili non mielinizzate nella pelle pelosa umana: risposta simpatica e localizzazione percettiva. Exp Brain Res. 2008; 184: 135-140. [PubMed]
Pagina AJ, Brierley SM, Martin CM, Martinez-Salgado C, Wemmie JA, Brennan TJ, Symonds E, Omari T, Lewin GR, Welsh MJ, et al. Il canale ionico ASIC1 contribuisce alla funzione dei meccanorecettori viscerali ma non cutanei. Gastroenterologia. 2004; 127: 1739-1747. [PubMed]
Peier AM, Moqrich A, Hergarden AC, Reeve AJ, Andersson DA, Storia GM, Earley TJ, Dragoni I, McIntyre P, Bevan S, et al. Un canale TRP che percepisce stimoli freddi e mentolo. Cellula. 2002a; 108: 705-715. [PubMed]
Peier AM, Reeve AJ, Andersson DA, Moqrich A, Earley TJ, Hergarden AC, Storia GM, Colley S, Hogenesch JB, McIntyre P, et al. Un canale TRP sensibile al calore espresso in cheratinociti. Scienza. 2002b; 296: 2046-2049. [PubMed]
Perl ER. Idee sul dolore, una visione storica Nat Rev Neurosci. 2007; 8: 71-80. [PubMed]
Petrus M, Peier AM, Bandell M, Hwang SW, Huynh T, Olney N, Jegla T, Patapoutian A. Un ruolo di TRPA1 nell'iperalgesia meccanica è rivelato dall'inibizione farmacologica. Mol Pain. 2007; 3: 40. [Articolo gratuito di PMC] [PubMed]
Polgar E, Hughes DI, Arham AZ, Todd AJ. La perdita di neuroni dalla lamina I-III del corno dorsale spinale non è richiesta per lo sviluppo dell'allodinia tattile nel modello di lesione neuropatica del nervo risparmiato. J Neurosci. 2005; 25: 6658-6666. [PubMed]
Porreca F, Ossipov MH, Gebhart GF. Dolore cronico e facilitazione decrescente midollare. Tendenze neurosci. 2002; 25: 319-325. [PubMed]
Price MP, Lewin GR, McIlwrath SL, Cheng C, Xie J, Heppenstall PA, Stucky CL, Mannsfeldt AG, Brennan TJ, Drummond HA, et al. Il canale di sodio mammiferi BNC1 è richiesto per la normale sensazione tattile. Natura. 2000; 407: 1007-1011. [PubMed]
Price MP, McIlwrath SL, Xie J, Cheng C, Qiao J, Tarr DE, Sluka KA, Brennan TJ, Lewin GR, Welsh MJ. Il canale cationico DRASIC contribuisce alla rilevazione del contatto cutaneo e degli stimoli acidi nei topi. Neurone. 2001; 32: 1071-1083. [PubMed]
Rau KK, Jiang N, Johnson RD, Cooper BY. Sensibilizzazione al calore in nocicettori cutanei e muscolari che esprimono distinte combinazioni di TRPV1 e proteina TRPV2. J Neurophysiol. 2007; 97: 2651-2662. [PubMed]
Rauck RL, Wallace MS, Burton AW, Kapural L, North JM. Ziconotide intratecale per il dolore neuropatico: una revisione. Pratica del dolore. 2009; 9: 327-337. [PubMed]
Reid G, Flonta ML. Fisiologia. Corrente fredda nei neuroni termorecettivi. Natura. 2001; 413: 480. [PubMed]
Ren K, Dubner R. Neuron-glia crosstalk diventa serio: ruolo nel dolore ipersensibilità. Curr Opin Anestesista. 2008; 21: 570-579. [Articolo gratuito di PMC] [PubMed]
Ritner HL, Machelska H, Stein C. Sistema immunitario Dolore e analgesia. In: Basbaum AI, Bushnell M, editori. Scienza del dolore. 2009. pp. 407-427.
Roza C, Puel JL, Kress M, Barone A, Diochot S, Lazdunski M, Waldmann R. Knockout del canale ASIC2 nei topi non compromette la meccanosensazione cutanea, la meccanonocicezione viscerale e l'udito. J Physiol. 2004; 558: 659-669. [Articolo gratuito di PMC] [PubMed]
Scherrer G, Imamachi N, Cao YQ, Contet C, Mennicken F, O'Donnell D, Kieffer BL, Basbaum AI. Dissociazione dei meccanismi dei recettori oppioidi che controllano il dolore meccanico e termico. Cellula. 2009; 137: 1148-1159. [Articolo gratuito di PMC] [PubMed]
Schmidt R, Schmelz M, Forster C, Ringkamp M, Torebjork E, Handwerker H. Nuove classi di nocicettori C reattivi e non responsivi nella pelle umana. J Neurosci. 1995; 15: 333-341. [PubMed]
Sivilotti L, Woolf CJ. Il contributo dei recettori GABAA e glicina alla sensibilizzazione centrale: disinibizione e allodinia evocata al tatto nel midollo spinale. J Neurophysiol. 1994; 72: 169-179. [PubMed]
Snider WD, McMahon SB. Affrontare il dolore alla fonte: nuove idee sui nocicettori. Neurone. 1998; 20: 629-632. [PubMed]
Storia GM, Peier AM, Reeve AJ, Eid SR, Mosbacher J, Hricik TR, Earley TJ, Hergarden AC, Andersson DA, Hwang SW, et al. ANKTM1, un canale simile a TRP espresso nei neuroni nocicettivi, viene attivato dalle basse temperature. Cellula. 2003; 112: 819-829. [PubMed]
Strotmann R, Harteneck C, Nunnenmacher K, Schultz G, Impianto TD. OTRPC4, un canale cationico non selettivo che conferisce sensibilità all'osmolarità extracellulare. Nat Cell Biol. 2000; 2: 695-702. [PubMed]
Sugai E, Morimitsu Y, Iwasaki Y, Morita A, Watanabe T, Kubota K. Qualità pungenti dei composti correlati a sanshool valutati da un test sensoriale e attivazione del ratto TRPV1. Biosci Biotechnol Biochem. 2005; 69: 1951-1957. [PubMed]
Suzuki M, Watanabe Y, Oyama Y, Mizuno A, Kusano E, Hirao A, Ookawara S. Localizzazione del canale motorosensibile TRPV4 nella pelle di topo. Neurosci Lett. 2003; 353: 189-192. [PubMed]
Swayne LA, Bourinet E. Canali voltaggio-dipendenti nel dolore cronico: ruolo emergente dello splicing alternativo. Pflugers Arch. 2008; 456: 459-466. [PubMed]
Takahashi A, Gotoh H. Meccanosensitive di correnti intere di cellule in neuroni somatosensoriali di ratti colti. Cervello. 2000; 869: 225-230. [PubMed]
Tanga FY, Nutile-McMenemy N, DeLeo JA. Il ruolo del CNS del recettore Toll-like 4 nella neuroimmunità innata e neuropatia dolorosa. Proc Natl Acad Sci US A. 2005; 102: 5856-5861. [Articolo gratuito di PMC] [PubMed]
Tominaga M, Caterina MJ, Malmberg AB, Rosen TA, Gilbert H, Skinner K, Raumann BE, Basbaum AI, Julius D. Il recettore della capsaicina clonato integra più stimoli che producono dolore. Neurone. 1998; 21: 531-543. [PubMed]
Torsney C, MacDermott AB. La disinibizione apre la porta alla segnalazione patologica del dolore nei neuroni superficiali neurocinetici 1 che esprimono il recettore nel midollo spinale del ratto. J Neurosci. 2006; 26: 1833-1843. [PubMed]
Recettori Tozaki-Saitoh H, Tsuda M, Miyata H, Ueda K, Kohsaka S, Inoue K. P2Y12 nella microglia spinale sono necessari per il dolore neuropatico dopo lesione del nervo periferico. J Neurosci. 2008; 28: 4949-4956. [PubMed]
Trevisani M, Siemens J, Materazzi S, Bautista DM, Nassini R, Campi B, Imamachi N, Andre E, Patacchini R, Cottrell GS, et al. 4-Hydroxynonenal, un'aldeide endogena, causa dolore e infiammazione neurogena attraverso l'attivazione del recettore irritante TRPA1. Proc Natl Acad Sci US A. 2007; 104: 13519-13524. [Articolo gratuito di PMC] [PubMed]
Recettori Tsuda M, Shigemoto-Mogami Y, Koizumi S, Mizokoshi A, Kohsaka S, Salter MW, Inoue K. P2X4 indotti in allodinia tattile della microglia porta spinale dopo lesione del nervo. Natura. 2003; 424: 778-783. [PubMed]
Ulmann L, Hatcher JP, Hughes JP, Chaumont S, Green PJ, Conquet F, Buell GN, Reeve AJ, Chessell IP, Rassendren F. L'up-regolazione dei recettori P2X4 nella microglia spinale dopo danno ai nervi periferici media il rilascio di BDNF e il dolore neuropatico. J Neurosci. 2008; 28: 11263-11268. [PubMed]
Verge GM, Milligan ED, Maier SF, Watkins LR, Naeve GS, Foster AC. Fractalkine (CX3CL1) e recettore di fractalkine (CX3CR1) distribuzione nel midollo spinale e gangli della radice dorsale in condizioni di dolore basale e neuropatico. Eur J Neurosci. 2004; 20: 1150-1160. [PubMed]
Viana F, de la Pena E, Belmonte C. La specificità della termotrasduzione a freddo è determinata dall'espressione differenziale del canale ionico. Nat Neurosci. 2002; 5: 254-260. [PubMed]
Wetzel C, Hu J, Riethmacher D, Benckendorff A, Harder L, Eilers A, Moshourab R, Kozlenkov A, Labuz D, Caspani O, et al. Una proteina dominio stomatina essenziale per la sensazione tattile nel topo. Natura. 2007; 445: 206-209. [PubMed]
Woodbury CJ, Zwick M, Wang S, Lawson JJ, Caterina MJ, Koltzenburg M, Albers KM, Koerber HR, Davis BM. I nocicettori privi di TRPV1 e TRPV2 hanno una normale risposta al calore. J Neurosci. 2004; 24: 6410-6415. [PubMed]
Woolf CJ. Evidenza per una componente centrale dell'ipersensibilità al dolore post-lesione. Natura. 1983; 306: 686-688. [PubMed]
Yagi J, Wenk HN, Naves LA, McCleskey EW. Correnti sostenute attraverso i canali ionici ASIC3 ai modesti cambiamenti del pH che si verificano durante l'ischemia miocardica. Circ Ris. 2006; 99: 501-509. [PubMed]
Yaksh TL. Correlati comportamentali e autonomici dell'allodinia tattile provocata dall'inibizione della glicina spinale: effetti dei sistemi recettori modulatori e degli antagonisti dell'amminoacido eccitatorio. Dolore. 1989; 37: 111-123. [PubMed]
Yang Y, Wang Y, Li S, Xu Z, Li H, Ma L, Fan J, Bu D, Liu B, Fan Z, et al. Mutazioni in SCN9A, codificante per una subunità alfa del canale del sodio, in pazienti con eritermia primaria. J Med Genet. 2004; 41: 171-174. [Articolo gratuito di PMC] [PubMed]
Zamponi GW, Lewis RJ, Todorovic SM, Arneric SP, Snutch TP. Ruolo dei canali del calcio voltaggio-dipendenti nelle vie dolorose ascendenti. Brain Res Rev. 2009; 60: 84-89. [Articolo gratuito di PMC] [PubMed]
Zhuang ZY, Kawasaki Y, Tan PH, Wen YR, Huang J, Ji RR. Ruolo del pathway CX3CR1 / p38 MAPK nella microglia spinale per lo sviluppo del dolore neuropatico in seguito alla scissione di fractalkine indotta da lesioni nervose. Brain Behav Immun. 2007; 21: 642-651. [Articolo gratuito di PMC] [PubMed]
Zimmermann K, Leffler A, Babes A, Cendan CM, Carr RW, Kobayashi J, Nau C, Wood JN, Reeh PW. Il canale del sodio dei neuroni sensoriali Nav1.8 è essenziale per il dolore alle basse temperature. Natura. 2007; 447: 855-858. [PubMed]
Zurborg S, Yurgionas B, Jira JA, Caspani O, Heppenstall PA. Attivazione diretta del canale ionico TRPA1 di Ca2 + Nat Neurosci. 2007; 10: 277-279. [PubMed]
Argomenti aggiuntivi: Dolore alla schiena
Mal di schiena è una delle cause prevalenti di disabilità e giornate perse al lavoro in tutto il mondo. Di fatto, il dolore alla schiena è stato attribuito come la seconda ragione più comune per le visite di un medico, superata solo dalle infezioni delle alte vie respiratorie. Circa il 80 percento della popolazione sperimenterà qualche tipo di dolore alla schiena almeno una volta nel corso della vita. La colonna vertebrale è una struttura complessa composta da ossa, articolazioni, legamenti e muscoli, tra gli altri tessuti molli. A causa di ciò, lesioni e / o condizioni aggravate, come dischi erniciati, può eventualmente portare a sintomi di mal di schiena. Le lesioni sportive o gli incidenti automobilistici sono spesso la causa più frequente di mal di schiena, tuttavia a volte il più semplice dei movimenti può avere risultati dolorosi. Fortunatamente, le opzioni di trattamento alternative, come la cura chiropratica, possono aiutare ad alleviare il mal di schiena attraverso l'uso di aggiustamenti spinali e manipolazioni manuali, in definitiva migliorando il sollievo dal dolore.

ARGOMENTO PIÙ IMPORTANTE: Gestione del mal di schiena
ALTRI ARGOMENTI: EXTRA EXTRA: dolore cronico e trattamenti
Disclaimer post
Le informazioni qui riportate su "Meccanismi di dolore acuto vs dolore cronico" non intende sostituire un rapporto individuale con un professionista sanitario qualificato o un medico autorizzato e non è una consulenza medica. Ti incoraggiamo a prendere decisioni sanitarie basate sulla tua ricerca e collaborazione con un professionista sanitario qualificato.
Informazioni sul blog e discussioni sull'ambito
Il nostro ambito informativo è limitato alla chiropratica, muscolo-scheletrica, agopuntura, medicine fisiche, benessere, contributo eziologico disturbi viscerosomatici all'interno di presentazioni cliniche, dinamiche cliniche associate ai riflessi somatoviscerali, complessi di sublussazione, problemi di salute sensibili e/o articoli, argomenti e discussioni di medicina funzionale.
Forniamo e presentiamo collaborazione clinica con specialisti di varie discipline. Ogni specialista è regolato dal proprio ambito di pratica professionale e dalla propria giurisdizione di licenza. Utilizziamo protocolli funzionali di salute e benessere per trattare e supportare la cura delle lesioni o dei disturbi del sistema muscolo-scheletrico.
I nostri video, post, argomenti, soggetti e approfondimenti trattano questioni cliniche, problemi e argomenti che riguardano e supportano direttamente o indirettamente il nostro ambito di pratica clinica.*
Il nostro ufficio ha ragionevolmente tentato di fornire citazioni di supporto e ha identificato gli studi di ricerca pertinenti a supporto dei nostri post. Forniamo copie degli studi di ricerca di supporto a disposizione degli organi di regolamentazione e del pubblico su richiesta.
Comprendiamo che copriamo questioni che richiedono una spiegazione aggiuntiva su come può essere d'aiuto in un particolare piano di assistenza o protocollo di trattamento; pertanto, per discutere ulteriormente l'argomento di cui sopra, non esitate a chiedere Dott. Alex Jimenez, DC, o contattaci al 915-850-0900.
Siamo qui per aiutare te e la tua famiglia.
Blessings
Il dottor Alex Jimenez DC MSACP, Marina Militare*, CCST, IFMCP*, CIFM*, ATN*
e-mail: coach@elpasofunctionalmedicine.com
Licenza come Dottore in Chiropratica (DC) in Texas & Nuovo Messico*
Licenza Texas DC n. TX5807, Licenza DC del New Mexico n. NM-DC2182
Licenza come infermiere registrato (RN *) in Florida
Licenza Florida N. licenza RN RN9617241 (controllo n. 3558029)
Stato compatto: Licenza multistato: Autorizzato ad esercitare in Stati 40*
Attualmente immatricolato: ICHS: MSN* FNP (Programma per infermiere di famiglia)
Dott. Alex Jimenez DC, MSACP, RN* CIFM*, IFMCP*, ATN*, CCST
Il mio biglietto da visita digitale




 Di nuovo ti diamo il benvenuto¸
Di nuovo ti diamo il benvenuto¸
